- 首頁
- 我們的服務
-
項目簡介
醫療器械檢測是確保產品安全、有效與合規的關鍵環節,涵蓋性能驗證、材料安全及生物相容性測試,旨在預防潛在風險,保護患者健康,推動行業持續發展。
服務項目
醫用敷料類、醫用輸注器具及醫用導管類、藥械組合醫療器械、醫美產品
服務優勢
資質完備:已獲得國家CMA、省級CMA及CNAS資質,檢測結果權威可靠。
項目全面:提供理化/微生物檢測、生物相容性研究(依據GB/T 16886/ISO 10993)及臨床前功能性評價的一站式服務。
專業團隊:擁有經驗豐富的檢測隊伍,精通各類醫療器械標準與流程,確保高效精準服務。
風險控制:通過體外/體內實驗綜合評價產品安全性,助力產品合規上市,提升市場競爭力。
-
服務簡介
華微檢測是由廣州高新區投資集團直屬單位聯合華南新藥創制中心及海歸技術團隊共同建設的第三方檢測機構,專注生物安全、生物醫藥與動物實驗等領域。我們搭建生物制品分析檢測綜合平臺,嚴格遵循ISO/IEC17025體系,已獲國家CMA和CNAS認證,提供符合《中國藥典》要求的細胞系/株全面檢定服務,適用于抗體、重組蛋白、疫苗、細胞基因治療產品等生物制品的合規報批。
服務項目
細胞庫檢測、生物制品批放行檢查/型式檢查、細胞內外源病毒因子檢查、原輔料/培養基/耗材檢查、工藝雜質殘留研究、微生態制劑(活菌制劑)檢查
服務優勢
權威資質:通過CMA、CNAS認證,實驗室符合GMP體系,檢測結果具法律效力和國際公信力。
高標準實驗室:配備多間加強型P2實驗室(廣州市備案),B+A環境,滿足無菌及病毒檢測要求。
法規符合性強:嚴格遵循FDA、CHP、EP、ICH等國際國內法規,建立全面細胞庫檢定流程。
專業團隊與技術:依托高水平技術團隊和完備操作規程,為客戶提供精準、高效的生物制品檢測服務。
-
服務簡介
我司提供全面的藥代藥效學研究評價服務。我們嚴格遵循NMPA、FDA和ICH相關技術指導原則,為客戶提供符合申報要求的全套體內外評價模型與試驗數據支持。
服務項目
藥代動力學研究、 藥效學研究、皮膚外用試劑透皮吸收研究
服務優勢
綜合平臺:整合藥代、藥效及透皮研究能力,提供從體外到體內的一體化評價方案。
專業團隊:擁有經驗豐富的研究人員,精通各類藥物劑型與模型的評價標準與法規要求。
先進設備:配備LC-MS/MS、高效滲透系統等先進儀器,保證數據精準、可靠。
合規高效:實驗過程嚴格遵循GLP規范,支持國內外注冊申報,加速產品研發與上市進程。
-
服務簡介
華微檢測提供專業的藥品及原輔料質量研究與檢測分析服務,配備精密儀器實驗室、核磁共振實驗室及多類先進分析設備,涵蓋理化性質分析、雜質研究、含量測定及方法開發與驗證等項目,全面支持藥品研發、生產及注冊申報的質量控制需求。
服務項目
藥品/原輔料理化檢查、藥品微生物檢查、效價與生物學活性、生物安全性檢測(生物制品)、抗菌/抗病毒藥物篩選
服務優勢
設備先進齊全:配置HPLC、LC-MS、GC-MS、ICP-MS、AAS、酶標儀等多類型高端儀器,保證檢測數據精準可靠。
技術能力深厚:具備藥品及原輔料方法開發與驗證經驗,可提供從常規檢測到復雜研究的全流程解決方案。
定制化服務:依據企業實際需求,提供靈活、高效的定制化開發與檢測服務,助力企業加速研發進程。
平臺資源豐富:依托完備的實驗室平臺和專業團隊,能夠同時應對多品類、多標準的藥品質量評價任務
-
服務簡介
新型冠狀病毒疫情嚴重危害人類健康,已成為全球關注的公共衛生問題。抗病毒材料作為一種重要的防護手段,可有效抑制和殺滅病毒,但其實際效果需通過專業檢測驗證。 隨著疫情防控常態化,市場對消毒及健康防護產品的需求持續增長,相關企業對于產品檢測的需求也日益迫切。 華微檢測為企業提供抗病毒材料及病毒消殺產品的專業檢測服務,助力產品有效性驗證,為公共健康保駕護航。
服務項目
凈化產品病毒去除性能測試、消毒產品病毒滅活效果測試、日化輕工材料抗病毒效果測試、精品定制化服務
服務優勢
精英團隊,背景多元:技術團隊由廣微所、華南新藥創制中心、高校重點實驗室人員及病毒學領域海歸博士專家組成,結構合理、實戰經驗豐富。
頂尖設備,科研級服務:依托先進硬件設施與高層次科研隊伍,在常規檢測中提供深度、沉浸式的科研體驗。
靈活定制,一站式支持:除標準化測試外,支持各類客供實驗方案,為產品開發與課題研究提供精品化、全方位技術服務。
-
服務簡介
食品保健品檢測是通過理化、微生物與毒理學等方法,對食品及保健品的成分、安全性、功效及標簽合規性進行全面分析的科學過程。 我們致力于通過檢測重金屬、農殘、微生物等風險物質,保證產品安全;驗證有效成分與宣稱功能,確保功效可信
服務項目
食品保健品毒理學檢測、食品保健品功效評價研究、其它定制化服務
服務優勢
符合國家標準與國際法規,助力市場準入; 具第三方檢測報告,增強消費者信任,提升產品競爭力。
-
華微檢測除核心檢測服務外,還可提供以下延伸技術支持:專業實驗空間租賃、定制化實驗方案設計、規范化的實驗動物代養 實驗方案設計是決定科研成敗與數據可靠性的關鍵環節。我們憑借專業團隊和豐富經驗,協助客戶根據研究目標與條件,設計科學、嚴謹、可操作的實驗方案,為項目順利開展提供堅實基礎。
- 新聞資訊
- 檢測流程
- 下載中心
- 關于我們
- 聯系我們
 新聞資訊INFORMATION CENTER支原體檢測方法大PK
新聞資訊INFORMATION CENTER支原體檢測方法大PK 4482次
4482次 2025-04-16
2025-04-16
實驗室和細胞工廠在細胞培養過程中,支原體污染一直是困擾我們的疑難雜癥。據統計,常規細胞培養中支原體污染一般能達到30%,甚至更多,嚴重干擾了實驗結果的可信度。因此,定期進行支原體檢測和去除,確保細胞培養體系內無支原體存在才能獲得準確有效的實驗數據。
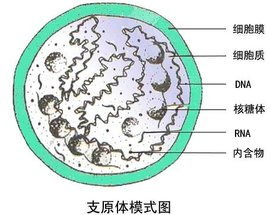
支原體是什么?
支原體是1898年Nocard等發現的一種類似細菌但不具有細胞壁的原核微生物,能在無生命的人工培養基上生長繁殖,直徑50-300nm,能通過細菌濾器。支原體在過去曾稱之為類胸膜肺炎微生物,1967年正式命名為支原體。
支原體又稱霉形體,為目前發現的較小較簡單的原核生物,基因數量為480。支原體細胞中唯一可見的細胞器是核糖體。支原體通常依附在細胞膜表面,結構也比較簡單,多數呈球形,沒有剛性的細胞壁,因此很多抗生素對其不起作用。只有三層結構的細胞膜,故具有較大的可變性。實驗室常見的種類有:口腔支原體、精氨酸支原體、豬鼻支原體、發酵支原體、人型支原體、唾液支原體、肺支原體和梨支原體等。
支原體污染的原因是什么?
支原體污染一直是困擾實驗室細胞培養的難題,其來源主要是有以下幾個方面:
1. 細胞之間交叉污染;
2. 工作環境或實驗器材的污染;
3. 實驗者無菌操作不佳;
4. 培養基或其他試劑污染;
5. 制備細胞的原始組織或器官的污染;
支原體污染的危害是什么?
細胞培養中的污染類型很多,其中細菌和真菌造成的污染相對比較容易檢測、預防和去除,然而支原體造成的污染很難察覺,即使生長密度高達107~109CFU/mL也很難有污染跡象(渾濁、pH變化等)。支原體污染后會導致細胞生長變慢,狀態變差,不會馬上使細胞致死,但會影響細胞內的各種參數,如改變細胞膜抗原性,改變細胞新陳代謝,干擾核酸的合成,改變DNA轉染效率導致染色體畸變等。
支原體檢測方法有哪些?
檢測支原體的方法一般有分離培養法、指示細胞培養法(DNA染色法)、化學發光法(特異酶學檢測)、ELISA法、PCR法。
1. 支原體分離培養法
支原體分離培養法是檢測支原體的金標方法,其檢測精確度較高。此方法非常經典,在世界范圍內得到廣泛認可,《中國藥典》2020版第四部分3301和歐洲藥典第六版2.6.7部分均有記載。這種方法是從可疑的細胞培養體系中取樣,并接種到培養基靈敏度檢查合格的支原體瓊脂培養基上,如果樣本中含有支原體,它們就會在支原體瓊脂基上生長,較終形成明顯可見的特征性菌落。
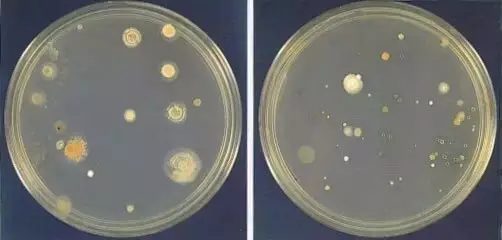
由于分離培養法基本不會出現假陰性結果,因此也被譽為支原體檢測金標準。不過分離培養法也存在兩個弊端,一是檢測時間太長,支原體要在培養基上長出明顯克隆需要4周左右,且操作也較復雜;二是盡管可以檢測絕大多數的支原體種類,但也存在個別無法檢測的情況,例如支原體M. hyorhinis。
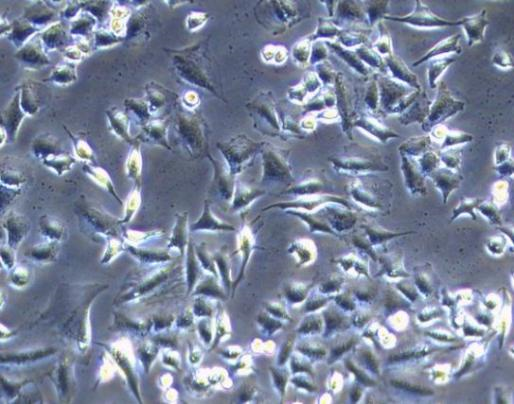
2. 指示細胞培養法(DNA染色法)
指示細胞培養法是指將供試品接種于指示細胞(一般選擇細胞質區域較大無污染的Vero細胞或經國家專業鑒定機構認可的其它細胞)中培養后,用特異熒光染料(如Hoechst染料)染色,然后在熒光顯微鏡下觀察。如供試品有支原體污染,就可以在指示細胞表面觀察到熒光斑點或熒光顆粒,與細胞核呈現的更大更亮橢圓形的熒光形成鮮明對比。

指示細胞培養法(DNA染色法)也是《中國藥典》2020版第四部分3301認可的支原體檢測方法,由于供試品要與指示細胞共同培養,因此也需要3~5天的時間。較大的優點就是較為快速,直觀,但是它的靈敏度會比較低,在支原體污染不嚴重時容易得到模棱兩可的結果,只有在污染嚴重時才能得到可靠度較高的結果。此外Hoechst染色試劑對人體有害,要注意防護;且固定液含有冰乙酸,有刺激性氣味,需要在通風櫥內進行固定操作;熒光染料都存在淬滅的問題,建議染色后盡量當天完成檢測。
3. 化學發光法(特異酶學檢測)
化學發光法的原理是利用支原體內特有的酶,與提供的底物相互作用,使其中的ADP轉化為ATP,熒光素酶可以利用產生的ATP與熒光素酶底物發生反應,能產生可以被儀器檢測到的光。如果沒有支原體存在,熒光素酶就沒有足夠的ATP去發生反應產生光,儀器檢測到的數值就比較低;如果有支原體存在,就可以使大量的ADP轉化為ATP,供熒光素酶發生反應,產生大量的光,儀器檢測到的數值就比較高。
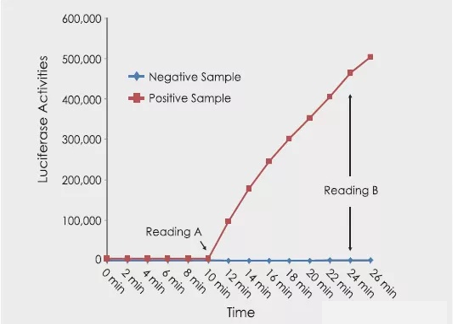
這種方法的優點是檢測的靈敏度高,速度快,但只能檢測活的支原體。
4. ELISA法
ELISA法也能用于支原體檢測,以ELISA法為基礎的支原體檢測一般使用針對支原體16S rRNA基因的帶標記探針或抗體,也有一些商品化的支原體Elisa試劑盒來檢測培養物中是否含有支原體。

ELISA法是一種很考驗操作者技術的檢測方法,而且很依賴抗體,有一定局限性,無法對沒有抗體或目前找不到抗體的支原體進行檢測,而且稍不留意就容易出現實驗誤差。方法相對復雜,用得也比較少。但是特異性高,時間也比較短,3~5小時就可以觀察結果。
5. PCR法
PCR法也是目前較常用的方法,它的檢測方式主要有凝膠電泳檢測和熒光PCR定量檢測。其原理都是在支原體16S rRNA基因的保守區設計引物,通過檢測支原體DNA來檢測細胞中有無支原體的污染。
在凝膠電泳過程中,支原體DNA會顯示為特異性條帶,以此指示支原體的存在。
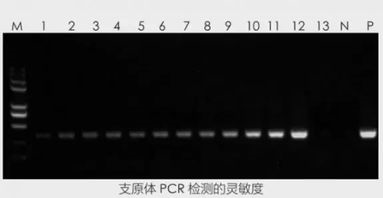
在用熒光PCR定量擴增時,觀察圖譜及Ct值可判斷是否有支原體存在。
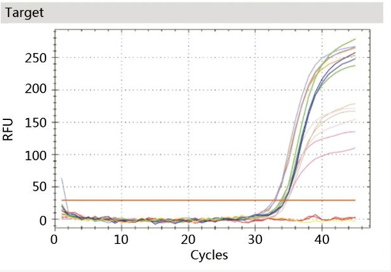
PCR法的優點是檢測靈敏度高,特異性好,檢測速度快,可在幾個小時內識別細胞培養物中是否有支原體污染。但存在測試過程中污染物易從陽性對照(或其他以前對支原體測試呈陽性的樣品)傳播到未受影響的樣品的風險,從而導致假陽性結果,此外也不能判斷滅活處理后的樣品是否還有活的支原體。
支原體非常頑強,通常用于細胞培養的絕大多數抗生素都對其無效。無懈可擊的細胞培養技術始終是預防支原體感染的較佳方式,另外及時找出受到支原體感染的培養物也很重要,這樣才能在感染擴散前快速采取有效措施。
祝實驗室各位小伙伴都能早日培養出自己心儀的細胞!
- 服務范圍
特色檢測服務 +
微生物制劑評價
抗菌抗病毒藥物篩選
抗生素效價檢測
醫療器械檢測 +
醫用敷料檢測
醫用輸注器具及醫用導管檢測
藥械組合醫療器械檢測
醫美產品檢測
生物制品檢測 +
細胞庫檢測
生物制品批放行檢查/型式檢查
細胞內外源病毒因子檢查
原輔料、培養基、耗材檢查
工藝雜質殘留研究
微生態制劑(活菌制劑)檢查
非臨床研究與生物樣本檢測 +
藥代動力學研究
藥效學研究
皮膚外用制劑透皮吸收研究
樣本分析檢測
病毒中和抗體檢測
藥品檢測 +
藥品、原輔料理化檢查
藥品微生物檢查
效價與生物學活性
抗菌/抗病毒藥物篩選
藥包材檢測
病毒殺滅檢測 +
凈化產品病毒去除性能測試
消毒產品病毒滅活效果測試
日化輕工材料抗病毒效果測試
精品定制化測試
食品/保健食品檢測 +
食品保健品毒理學檢測
食品保健品功效評價研究
其它定制化服務
其他檢測服務 +
化妝品原料毒理檢測
化妝品體外功效評價
化妝品/美容儀體內外透皮吸收評價
實驗動物飼/寄養服務
動物誘發性造模
儀器設備共享服務
分子生物學實驗技術服務平臺
ELISA實驗技術服務
熒光定量PCR實驗技術服務
Western Blotting實驗技術服務
外源性生物殘留檢測服務平臺
病毒核酸參考品服務
- 聯系我們
- 聯系人:史工18928790749、嚴工
- 手機:19924323595、020-82118202、020-31608627【微信同號】
- 微信號:
掃碼添加史工 掃碼添加嚴工
- 郵箱:yanyongxian@gdhvt.com
- 地址:廣州市黃埔區攬月路3號F棟316(總部)廣州市黃埔區科學城尖塔山路1號(動物中心)

 為您推薦更多
為您推薦更多

掃碼添加史工 掃碼添加嚴工
聯系人:史工18928790749、嚴工
聯系電話:19924323595、020-82118202、020-31608627
地址:廣州市黃埔區攬月路3號F棟316(總部)廣州市黃埔區科學城尖塔山路1號(動物中心)
版權所有 ? 廣東省華微檢測股份有限公司一级特黄av | 先锋男人资源 | 在线h网 | 性色在线观看 | 黑白配av | 韩日成人 | 91青青操| 西西44rtwww国产精品 | 在线成人亚洲 | 国内精品99 | 伦理2男一女3p | 亚洲天堂手机版 | 操的我好爽| 北条麻妃一区二区三区免费 | 丰满人妻综合一区二区三区 | av在线播放网址 | 少妇二级淫片免费天气预报 | bl无遮挡高h动漫 | 国产一区91精品张津瑜 | 国语对白一区 | 侵犯小太正gay初精视频 | 成人久久久精品乱码一区二区三区 | 日韩一区二区三区不卡 | 美女丝袜啪啪 | 国产精品免费一区二区三区都可以 | 亚洲一区人妻 | 日韩一二三四五区 | 久免费一级suv好看的国产 | 久久色视频 | 成人麻豆视频 | 三级国产在线观看 | 午夜18视频在线观看 | 日本成人一区二区 | 视频一区在线观看 | 日韩深夜视频 | 蓝猫淘气三千问恐龙时代 | 成人午夜电影在线观看 | 欧美www视频 | 黄视频网站在线观看 | 91扣逼| 国产综合在线观看 | 色播导航| 美利坚合众国av | 深夜福利网站 | 国产色视频 | 男女操操 | 成人麻豆视频 | 成人免费版欧美州 | 色人阁av| 老牛嫩草二区三区观影体验 | 一本久久综合亚洲鲁鲁五月天 | 日韩久久久久久久久久 | 成人免费毛片w下载 | 色男av| 亚洲1234区| 欧美日韩人妻精品一区二区三区 | 韩国深夜啪啪综艺无删减 | 伊人一区 | 99热日本 | 精品在线播放 | 精品国产va久久久久久久 | 日韩三级av | 污到下面流水的视频 | 狠狠狠狠干 | www.天天射| 国产又黄又粗又猛又爽 | 粗大的内捧猛烈进出视频 | 国语对白一区 | 亚洲免费影院 | 免费看黄色av| 特级黄色大片 | 成人免费无遮挡无码黄漫视频 | 亚洲91视频 | www男人天堂 | 香蕉啪啪 | 调教撅屁股啪调教打臀缝av | 男人天堂网av | 欧美一级艳片视频免费观看 | 少妇无套内谢久久久久 | 狠狠干网址 | 超碰成人97 | 怡红院一区二区三区 | 97色干 | 亚洲欧洲在线播放 | 久久久777| 91亚洲综合 | 亚洲视频一区二区 | 姐姐8免费完整高清电视剧在线看 | 黄色污网站在线观看 | 一区二区日韩精品 | 国产毛片一区 | 天天躁夜夜躁狠狠躁av | 又黄又色的视频 | 91亚洲综合 | 日本高清xxx | 小舞被调教成奶奴魅魔视频 | 国产精品国产一区二区三区四区 | 欧美午夜精品久久久久久人妖 | 99热成人| 男女啪啪在线观看 | 在线国产精品视频 | 爱情岛亚洲首页论坛 | 久久国产精品免费视频 | 亚洲精品1区2区3区 黄色三级图片 | 国产femdom调教7777 | 播播激情网 | 久久av网站 | 视频污| 国产小视频在线看 | 国产精品v亚洲精品v日韩精品 | 91五月天| 欧美性生活xxx | 欧美视频在线观看一区二区 | 色欲av伊人久久大香线蕉影院 | 九九精品影院 | 日本黄色大片网站 | 精品福利在线观看 | 国产又爽又黄免费视频 | 九九精品影院 | 制服.丝袜.亚洲.中文.综合懂 | 她享受粗啪滋嗯大爷轻点视频 | 好男人网站 | 欧美丰满熟妇bbbbbb | 久久国产一级 | 高h校园不许穿内裤h调教 | 强videoshd酒醉 | 中文字幕日韩三级片 | 麻豆av免费看 | 污视频免费网站 | 久久视频这里只有精品 | 高h视频在线播放 | 性日本xxx | 精品午夜福利在线观看 | 欧美精品在线一区 | 久热精品视频在线观看 | 偷啪自啪| 免费黄色av电影 | 欧美三级黄色 | 久免费一级suv好看的国产 | 中文字幕亚洲欧美 | 久久精品视频一区 | 俄罗斯特级毛片 | 自拍偷自拍亚洲精品播放 | 91香蕉国产在线观看软件 | 美利坚合众国av | 大尺度男男 | 国产精品熟女一区二区不卡 | 女女同性高清片免费看 | 成人在线观看网站 | 男人天堂网av | 色就色欧美 | 久久精品一区 | 亚洲欧美国产视频 | 欧美在线免费观看 | 亚洲黄色成人 | 小泽玛利亚一区二区三区视频 | av在线小说| 91av在线免费| 日视频 | 色接久久 | 午夜精品久久久久久久久久 | 二级电影 | 日本少妇xxxx动漫 | 九九九九九精品 | 欧州毛片 | 日本xx视频 | 老鸭窝成人 | 色撸撸在线视频 | 国产欧美一区二区精品忘忧草 | 久久手机视频 | 先锋成人资源 | 91九色视频在线观看 | 91麻豆精品国产91久久久更新资源速度超快 | 日韩在线网 | 少妇熟女高潮流白浆 | 好男人网站 | 丁香花高清在线 | 少妇精品| 久久e久久 | 欧美福利社| 电影《色戒》无删减版 | 扒开双腿让70岁老头看 | 日本高清视频www | 国产中文在线观看 | 曰批女人视频在线观看 | 国产一区二区视频免费 | 亚洲久久色 | 麻豆视频免费版 | 国产一区二区三区四 | 手机在线免费看毛片 | 亚洲最新 | 裸体女人免费视频 | 国产一级一片免费播放 | 午夜视频免费 | 精品视频一区二区三区 | 波多野结衣在线一区二区 | 公交车被多人伦h | 久久精品噜噜噜成人 | 伊人夜夜躁av伊人久久 | 欧洲黄网 | 污的网站 | 综合网激情 | 91热久久 | 91在线精品一区二区 | 国产精品无码在线播放 | 国产熟女精品视频 | 欧美丰满熟妇bbbbbb | 免费看女生隐私 | 五月婷婷视频 | 久久久久久蜜桃 | 91视频精品 | 日韩电影一二三区 | 色涩综合 | 住在隔壁的她动漫免费观看全集下载 | 丰满肉肉bbwwbbww | 国产ts系列 | 国产精品夜夜夜爽张柏芝 | 伊人成综合网 | 精品国产乱码 | 欧洲视频一区 | 成人在线观看网站 | 亚洲精品一二 | 免费激情视频网站 | 欧美视频在线观看免费 | 黄色动漫在线看 | 91污在线观看 | 凸凹视频在线观看 | 17c在线观看视频 | 91成人在线 | 成年人在线观看免费视频 | 五月激情丁香 | av手机版| 亚洲一区电影 | 女人的呻吟声 | 重口味av | 亚洲拍拍 | 侵犯小太正gay初精视频 | 性free毛茸茸videos | 花样视频污| 日本a级在线 | 国产九九九九 | 裸体女人a级一片 | 日韩福利电影在线观看 | 成人激情综合网 | 中文字幕黑人 | 午夜激情婷婷 | 在线观看国产成人 | 男人肌肌桶女人肌肌 | avtt中文字幕| 久久精品午夜 | 在线观看中文字幕网站 | 一区二区三区四区亚洲 | 日韩人妻无码一区二区三区 | 性插图互舔| 欧美激情在线免费观看 | 人妻精品久久久久中文字幕69 | 很嫩很紧直喷白浆h | 久草综合在线视频 | 美女啪啪网 | 色人阁视频 | 亚洲一区人妻 | 亚洲一区二区免费看 | 欧美老司机 | 黄色免费毛片 | 在线免费观看黄视频 | 91香蕉国产在线观看软件 | 少妇交换做爰1 | 脱内衣裸身吻胸床戏 | 97人人爱| 日韩精品午夜 | 台湾swag在线播放 | 国产精品熟女一区二区不卡 | 色欲av伊人久久大香线蕉影院 | 日韩一本 | 免费色网 | 成年视频在线 | 好男人www社区在线视频夜恋 | 国产精品久久久久久无人区 | av网址在线免费观看 | 亚州高清| 男女做爰猛烈高潮描写 | 丰满少妇被猛烈进入无码 | 久久裸体| 开心色99 | 国产青青视频 | 免费看成人毛片 | 污网站免费观看 | 91在线日韩 | 国产一区二区自拍视频 | 99久久久久久 | 国产三级在线免费观看 | 嫩草嫩草嫩草嫩草嫩草嫩草 | 国产欧美精品在线 | 人妻熟女一区二区三区 | 看黄免费| 亚洲视频久久 | 不卡日韩 | 欧美人与性动交g欧美精器 国产91在线播放精品91 | 伊人夜夜躁av伊人久久 | 推特在线观看 | 久久久久一区二区 | 国模一二三区 | 潘金莲三级80分钟 | 亚洲爱色 | 日韩av一级 | 国产精品无码在线播放 | 波多野结衣av在线观看 | 一本之道av| 成人国产一区二区 | 中文字幕av电影在线观看 | 国产精品成人免费看片 | 丰满人妻熟女aⅴ一区 | 四虎4hu| 欧美在线中文 | 综合久久精品 | 黄色性生活一级片 | 欧美在线中文 | 国产精品91视频 | 国产精彩视频 | 国产日韩欧美视频 | 男女作爱免费网站 | 日韩日b视频 | 在线a天堂 | 中文字幕在线亚洲 | 制服.丝袜.亚洲.中文.综合懂 | 日韩一二三四五区 | 欧美成人h版史密斯夫妇 | 免费看黄色的网站 | 黄色精品在线 | 亚洲福利一区二区 | 波多野结衣视频在线播放 | 亚洲欧洲日韩综合 | 国产激情av | 日韩一区二区三免费高清在线观看 | 亚洲色图欧美日韩 | 日韩成人午夜电影 | 久久亚洲国产成人精品性色 | 99视频网站 | 成人麻豆视频 | 成人久久久精品乱码一区二区三区 | 爽交换快高h中文字幕 | 久久99久| 黄色片大全 | 亚洲国产成人久久 | 91麻豆精品国产91久久久久久久久 | 成人观看视频 | av无遮挡| 亚洲一二三四 | 少妇av一区二区三区 | 午夜电影免费看 | 天天操比 | 大波大乳videos护士 | 老妇女毛片 | 日日麻批| 国产在线免费 | 九九色视频 | 琪琪久久 | 欧美在线高清 | 九九热精品免费视频 | 国产三级午夜理伦三级 | 亚洲成人毛片 | 9l蝌蚪porny中文自拍 | 西西午夜 | 国产小视频在线看 | 伊人一区| 黄色永久网站 | 九九久久精品视频 | 欧美福利视频 | 黄在线观看 | 九九热精品在线 | 日本成人在线播放 | 久久视频这里只有精品 | 亚洲精品久久久久中文字幕二区 | 哪个网站可以看毛片 | 爆操jk| 国产精品久久av | 日韩大片在线观看 | 精品播放 | 九九精品影院 | 亚洲一区二区自拍 | 男女啪啪在线观看 | 久久久在线观看 | 美女aaa | www.在线 | 国产青青视频 | 中国女人真人一级毛片 | 女人下边被添全过视频 | 欧美妞干网 | 中文日韩字幕 | 青青草免费公开视频 | 网站晚上你懂 | 深夜爽爽动态图无遮无挡 | 国产精品美女毛片真酒店 | 免费无码毛片一区二区app | 粉嫩av四季av绯色av | 男女视频在线观看免费 | 男女超碰 | 欧美一区2区 | 久久久久女人精品毛片九一 | 天天cao| 自拍视频网 | 欧美裸体女人 | 日韩在线观看网站 | www.日本黄 | 亚洲一区中文字幕在线观看 | 浪漫樱花动漫在线观看免费 | 东方影库av| 欧美国产日韩一区 | 三级性生活片 | 污的网站| 椎名空在线 | 精品国产乱码久久久久久婷婷 | 欧美一级大片在线观看 | 高h言情 | 欧美做受69| 波多野结衣电影av | 神马久久久久久久久 | 手机av免费在线观看 | 啊啊嗯视频 | 毛片小网站 | 窝窝午夜精品一区二区 | 国产精品, | 少妇的逼逼| 91精品91久久久中77777 | 91福利app| av资源网址 | 超碰超碰超碰超碰 | 高跟肉丝丝袜呻吟啪啪网站av | 日本人性爱视频 | 精品久久蜜桃 | 久久最新网址 | 天堂久久久久久久 | 美日韩一区二区 | 爆乳熟妇一区二区三区 | 日韩看片| 欧美日韩一二三四 | 制服.丝袜.亚洲.中文.综合 | 色图插插插 | 人妻精品一区二区三区 | 青春草视频在线 | 进去里视频在线观看 | 火影黄动漫免费网站 | 99热成人 | 欧美涩涩涩 | 亚洲永久av | 欧美猛交免费 | 亚洲免费观看高清 | 她享受粗啪滋嗯大爷轻点视频 | 日韩国产精品一区 | 国内精品久久久久 | 第一福利丝瓜av导航 | 色戒电影未测减除版 | 又大又长粗又爽又黄少妇视频 | 亚洲三级黄 | 我和漂亮女邻居做爰5 | 久久99网 | gogogo日本免费观看电视剧最 | 精品人伦一区二区三区 | 高跟鞋和丝袜猛烈xxxxxx | 国产真实乱人偷精品视频 | 欧美成人免费网站 | 亚洲xx视频 | 三级av在线 | 久久最新网址 | 欧美性在线视频 | 日韩两性视频 | 三级三级久久三级久久18 | 久久免费视频观看 | 超碰97av | 96视频在线观看 | 爽爽淫人网 | 欧美亚洲激情 | 亚州av片| 男同小说肉文 | 图书馆的女友在线观看 | 91香蕉国产在线观看软件 | 免费a网站 | 国产又粗又猛又黄又爽无遮挡 | 视频一区二区在线 | 天天爱天天射 | 亚洲一区国产精品 | 亚洲第一在线视频 | 中文字幕观看视频 | 成人福利在线视频 | 插曲免费高清在线观看 | 9l蝌蚪porny中文自拍 | 成人免费网站 | 91福利视频在线观看 | 亚洲午夜精品视频 | 免费在线观看毛片 | 欧美一区2区| 女人的呻吟声 | 国产1页| 性free公交车videos | 在线观看理论片 | 小视频黄色 | 日韩精品视频免费播放 | 蜜桃成人免费视频 | 2020av在线 | 99re在线观看 | 91成人在线观看喷潮蘑菇 | 亚洲区在线 | 又黄又骚的视频 | 婷婷深爱五月 | 国产小视频在线看 | 人妻熟女一区二区三区 | 啊啊啊啊啊好多水 | 日日夜夜精品视频免费 | 国产精品天天狠天天看 | 男女吻胸做爰摸下身 | 九色91| 欧美另类亚洲 | 激情六月 | 男人把女人桶爽 | 大尺度做爰呻吟舌吻 | 99中文字幕在线观看 | 欧美一级大片在线观看 | 无遮挡美女 | 亚洲欧美另类在线观看 | 啪啪福利视频 | 日韩人妻无码一区二区三区 | 中文字幕一区二区三区乱码不卡 | 日本护士ⅹ动态图 | 人成午夜 | 精品一区二区三区在线视频 | 日韩午夜在线观看 | 麻豆传媒网 | 日韩三级在线免费观看 | 侵犯小太正gay初精视频 | 欧美精品在线一区 | 欧美日韩在线免费 | 日韩jizz| 中文字幕人妻一区二区在线视频 | 日本三级视频在线观看 | 79日本xxxxxxxxx14 成人天堂 | 日本黄色录相 | 91av在线看 | 圣女被打开双腿触手调教视频 | 亚洲欧洲日韩国产 | 精品国产乱码久久久久久婷婷 | 精品黑人一区二区三区 | 自拍偷拍亚洲天堂 | 国产精品一区在线观看 | 99精品视频在线观看免费 | 深夜国产在线 | 日本三级影院 | 久久国产精品免费视频 | 色五丁香| 国产入口 | 牛牛澡牛牛爽一区二区 | 免费黄色网页 | 狠狠影院 | 天堂网2018| 疯狂欧美大伦交乱 | 涩涩网址 | 黄色污污视频在线观看 | 天天干狠狠爱 | 欧美三级电影网址 | 国产乱淫av | 色妞色视频一区二区三区四区 | 四虎在线免费视频 | 日本黄色美女视频 | 亚洲精品女人 | 人妖被c到高潮欧美gay | 黄色免费网站大全 | 久免费一级suv好看的国产 | 日少妇b| 伊人成综合网 | 午夜免费福利电影 | 在线观看国产 | 成人av观看 | 国产美女喷水 | 夜夜骑天天干 | 色呦呦在线视频 | 日韩免费三级 | 午夜黄色小说 | 日本一区二区精品视频 | 天天操天天干天天操 | 亚洲国产精品久久久久 | 午夜福利视频 | 一本久久道 | 国产男女猛烈无遮挡免费视频动漫 | 国产福利一区二区 | 1985美国式禁忌4 | 精品麻豆 | 成年人的免费视频 | 亚洲一区在线播放 | 亚洲第一男人天堂 | 丰满的保姆 | 69视频免费观看 | 在线看中文字幕 | 色婷婷伊人 | 欧美成人免费观看 | 韩国久久久 | av黄色在线播放 | 日本少妇xxxx动漫 | 一区二区精品 | 白嫩小受男同打屁股gay3p | 国内精品久久久久 | 神马久久久久久久久 | 亚洲熟妇无码久久精品 | 欧美最猛性xxxxx(亚洲精品) | 国产一区二区在线视频 | 军人武警gay男同gvus69 | 最新女另类z000z000 | 亚洲中文字幕无码爆乳av | 三级黄色av| 内衣办公室第一集 | 欧美做受视频 | 久久久精品影院 | 日本一区二区三区视频在线观看 | 老司机免费在线视频 | 在线日本中文字幕 | 亚洲视频在线免费播放 | 久久伊人五月天 | 91资源在线免费观看 | 激情文学视频 | 99re这里| 日韩福利电影在线观看 | 青青草自拍| 69精品人人人人 | 成人综合激情网 | 国产盗摄在线观看 | 日本裸体女优 | 久久视频精品 | 亚洲免费观看高清 | 在线天堂中文在线资源网 | 日日夜夜爽爽 | 91香蕉在线 | 免费毛片大全 | 校园春色综合 | 免费色网站 | 91高清免费视频 | 一级二级毛片 | 欧美一级大片在线观看 | 最新中文av | 国产精品a久久久久 | 男同小说肉文 | 在线看91 | 日本中文字幕在线播放 | 综合激情五月婷婷 | 污污在线 | 国产又粗又猛又爽又黄91精品 | 同学聚会2交换做爰 | 老色鬼在线 | 成人日批视频 | 粗了大了 整进去好爽视频 日韩一区二区三区电影 | xxx在线视频 | 日韩无码精品一区二区三区 | 日韩欧美国产精品 | 日韩精品一区二区三区四区五区 | 欲奴性猛交3未删减 | 好大好爽好舒服 | 91人妻一区二区 | 国产精品熟女一区二区不卡 | 日韩欧美一区在线 | 亚洲77777| 一区二区欧美日韩 | 深夜福利视频导航 | 在线a天堂 | 天堂在线8 | 伦理2男一女3p | 色哟哟一区二区 | 沈悦高志欣 沈镇南原著小说 | 后宫流全肉h文艳文 | 午夜精品av| 国产综合在线视频 | 国产精品久久久久久无人区 | 日韩视频在线观看免费 | 欧洲亚洲一区二区三区 | 青青草原成人 | 九九国产视频 | 一二三四在线视频 | 羞耻调教憋尿(高h,1v1) | 国产欧美日韩综合 | 秋霞午夜电影网 | 亚洲国产精品久久久久 | 成人一区二区三区在线 | 青青草原国产 | 午夜精品久久久久久久99热浪潮 | 少妇邻居做爰5 | 亚洲天堂日本 | 国产福利午夜 | 麻豆蜜桃91 | 日韩成人免费观看 | 国产在线一二三 | 中文字字幕 | 久久久成人av | 欧美一性一乱一交一视频 | 久艹av | 久草视频观看 | 在线免费观看日韩av | 日批视频免费看 | 女同互舔视频 | 国产入口 | 人人澡人人干 | 在线观看免费视频a | 牛牛视频在线 | 久久久久久综合 | 看看毛片 | 污片网站在线观看 | 亚洲久久网 | 视频在线免费 | 99视频99| 亚洲欧美另类自拍 | 91天堂在线 | 日本一区视频在线观看 | 波多野结衣 一区 | 毛茸茸的孕妇孕交xxxx | 丁香花高清在线 | 国产视频一区在线观看 | 精品女同一区二区 | 精品国产乱码久久久久久郑州公司 | 六月婷婷网 | 浮力影院国产第一页 | 男的艹女的视频 | 欧美高清在线观看 | 艳母视频在线观看 | 天堂中文字幕在线观看 | 婷婷色六月 | 调教撅屁股啪调教打臀缝av | 欧美激情视频在线 | 久久99久久99精品蜜柚传媒 | 9.1人网站免费 | free性video法国极品 | 天堂av2014| 岛国av在线 | 日韩欧美91 | 美女xx| 国产小u女发育末成年 | 69亚洲 | 精品久久久av | 中文字幕日韩三级片 | 午夜伦理在线观看 | 丁香视频在线观看 | 91看片淫黄大片91桃色 | 越南黄色片| 91精品免费视频 | 献给魔王伊伏洛基亚吧动漫在线观看 | 久久久精品影视 | 美女抠逼喷水 | 国产精品一区二 | 男男涩涩小说 | 蜜桃成人免费视频 | av电影在线观看网址 | 波多野结衣在线电影 | 黄色免费毛片 | 亚洲天堂网在线观看 | 欧美九九九 | 国产精品午夜影院 | 日韩一区精品 | 狠狠婷婷 | av日韩精品| 成人精品视频一区二区三区尤物 | 国产三级在线观看视频 | 日韩另类小说 | 国产99久久九九精品无码免费 | 毛片直接看 | 午夜黄色大片 | 国产无套精品一区二区 | 乖乖女的野男人们np | 美脚の诱脚舐め脚视频播放 | 午夜剧场福利 | 欧美国产精品一区 | 男人j进入女人j内部免费网站 | 丰满熟女人妻一区二区三 | 黄色片www | 国产精品99久久久精品无码 | 国产成人一区二区三区 | 噜噜色av | 成年人免费视频网站 | 久久国产综合 | 亚洲午夜影视 | 中文字幕一二区 | 久久亚洲国产成人精品性色 | 日本黄色美女视频 | 日本不卡三区 | 名校风暴在线观看免费高清完整 | 91性色| 女人的超长巨茎人妖3d | 国产精品丝袜 | 久久精品丝袜高跟鞋 | 国产永久精品大片wwwapp | 国产午夜精品一区二区三区视频 | 蜜桃av乱码一区二区三区 | 免费看裸体网站 | 国产盗摄在线观看 | 婷婷成人在线 | 长腿校花呻呤迎合娇躯白嫩小视频 | 在线高清av | 久久免费视频网 | 国产极品久久久 | 91在线观看高清 | 婷婷色一区二区三区 | 亚洲福利一区二区 | 伦理片av| 一边亲嘴一边做好爽视频 | 最新女另类z000z000 | 午夜免费福利电影 | 久久裸体视频 | 亚洲色图欧美在线 | 国产综合日韩 | 97成人资源 | 黄色特级视频 | 丁香花五月天 | 欧美最猛性xxxxx(亚洲精品) | 日韩成人免费在线视频 | 黑人干亚洲人 | 成人av免费播放 | 超级碰碰视频 | 国产一区在线视频 | 4虎影音| 男人捅女人网站 | 日韩黄色小说 | 嫩草影院在线观看视频 | 扒开女人内裤猛进出白浆 | 啊室友轻点h总攻 | 欧美三级欧美一级 | 欧美一区2区 | 欧美天天射| 91在线精品一区二区 | 舔的好舒服 | 国产免费大片 | 69亚洲 | 男女拍拍视频 | 国产剧情在线视频 | 天堂网中文 | 欧美成人免费观看 | 性吧av| 在线观看免费福利 | 久久久夜色精品亚洲 | 欧美成人一区二区三区在线观看 | 日本免费福利视频 | 99热日本 | 伊人网站在线观看 | 性色tv| 91禁在线动漫 | 免费v片在线观看 | 91玖玖| 日韩欧美中文 | 中文字幕天堂网 | 亚洲二三区 | 欧美一区二区激情视频 | 三级伦理片在线观看 | 不卡在线| 97毛片| 精品欧美一区二区三区 | 黑白配在线观看免费观看 | 东方影库av | 国产日韩精品在线 | 国产一级二级三级视频 | 亚洲在线视频播放 | 国产精品成人免费看片 | 啊用力嗯轻一点h | 久草视频免费在线播放 | 中文字字幕 | 自拍偷自拍亚洲精品播放 | 蜜桃成人在线观看 | 日韩福利电影在线观看 | mm131丰满少妇人体欣赏图 | 蜜桃成人在线观看 | 黄色精品网站 | 国产情侣小视频 | 毛片网页 | 天天爽夜夜爽夜夜爽 | 国产小视频在线看 | 中文字幕精品一区久久久久 | 精品国产麻豆 | 丰满少妇在线观看网站 | 久久精品噜噜噜成人 | 久久久久久蜜桃 | 成人免费版欧美州 | 天天做天天干 | 亚洲一卡二卡在线 | 欧美黄色特级片 | 小舞被调教成奶奴魅魔视频 | 潘金莲一级淫片 | 亚洲人视频 | 青青草一区 | 深夜爽爽动态图无遮无挡 | 姐脱你看 | 色噜噜一区二区三区 | 操的我好爽 | 日韩中文字幕 | 在线观看麻豆视频 | 成人h在线观看 | 成年人激情网 | 另类尿喷潮videofree | 一级成人毛片 | 欧美精品在线一区 | 亚洲免费一区 | 亚洲黄色网址 | 娇妻被肉到高潮流白浆 | 亚洲久久网 | 羞耻调教憋尿(高h,1v1) | 岛国在线免费视频 | 欧美精品入口蜜桃 | 一级肉体全黄裸片中国 | 亚洲黄色片网站 | 久久av资源 | 自拍偷自拍亚洲精品播放 | 无码人妻丰满熟妇啪啪网站 | 久久一本 | 欧美丰满老熟妇xxxxx性 | 黄色wwww| 一级片在线免费看 | 国产日韩精品入口 | 亚洲成人第一页 | 中国特级毛片 | 久久久香蕉视频 | 欧美第一网站 | 在线免费观看黄视频 | 日本免费福利视频 | 做爰全过程叫床视频 | 毛片小网站 | 天天操天天射天天 | 二级黄色大片 | 麻豆三级 | 麻豆传媒网 | 午夜黄色小说 | 日韩一二三级 | 色屁屁网站 | 亚洲 激情 小说 另类 欧美 | 亚洲精品福利 | 日韩电影在线一区 | 青青艹av | 日本美女一区二区 | 苍井空无码 | 白色白色在线视频 | 17c在线观看视频 | 99热国内精品| 免费福利视频网站 | 国产精品入口久久 | 色就色欧美 | 色伊人av | 中国一级大黄大黄大色毛片 | 五月综合视频 | 在线观看免费视频a | 国产精品久久久久久久久久久久久久久久久久 | 污到下面流水的视频 | 99久久九九| 91精品国产综合久久久蜜臀九色 | 圣女被打开双腿触手调教视频 | 久久午夜夜伦鲁鲁一区二区 | 欧美性伦理| 最近更新中文字幕 | 小十四萝裸体乱喷小说 | 日韩在线观看第一页 | 亚洲精品色 | 天堂在线| 一区二区精品视频 | 国产成人欧美 | 日本丰满熟妇videossex | 亚洲黄色在线观看视频 | 成人黄色在线视频 | 四虎永久免费 | 欧美裸体女人 | 免费99精品国产自在在线 | 熟女毛毛多熟妇人妻aⅴ在线毛片 | 草莓视频在线观看免费下载 | 天堂8中文在线 | 日韩三级久久 | 久久久久国产视频 | 五月天国产| 久久久久久久久久一区二区三区 | 视频区图片区小说区 | 婷婷av在线 | 国产高清不卡视频 | 奇米影视色 | 成人激情视频网 | 在线高清观看免费观看 | 免费看污片网站 | 国产一区二区在线视频 | 久久久久久精 | 欧美另类亚洲 | 人妻大战黑人白浆狂泄 | 天天爽天天射 | 久久久久久9 | 香蕉视频官网 | 在线v片 | 欧美香蕉视频 | 公交车上和陌生人做了爱 | 国产污视频 | 日韩精品一区二区三区高清免费 | 一级肉体全黄裸片中国 | 国产精品高潮呻吟久久久 | 黄色免费片| 特黄一级毛片 | 波多野结衣一区二区三区四区 | 91色交视频 | 中文字幕在线观看一区 | 亚洲视频免费 | 国产乱淫av片免费 | 欧美一级免费观看 | 国产av无码专区亚洲a∨毛片 | 高潮捣出白浆嗯啊哭叫 | 免费观看在线高清 | 在线观看免费 | 男男全程肉无删减电影 | 日本黄色网址大全 | 中文字幕亚洲在线 | 一级少妇片 | 天天操天天摸天天干 | 亚洲另类视频 | 91热久久 | 91亚洲综合 | 精品一区二区三区免费 | 91素人约啪 | 中国xxxxxxxxx| 久久久久久看片 | 俺也去av | 成人av福利 | 国产精品免费一区二区三区都可以 | 久久av资源 | 日韩日b视频 | 丰满熟女人妻一区二区三区 | 欧美高清hd | 激情亚洲色图 | 在线免费观看一级片 | 97国产精品人人爽人人做 | 在线看中文字幕 | av免费高清| 欧美《交换做爰》电影 | 乖…忍一下我就进一点视频 | 女性向av| 91偷拍网 | 丝袜+亚洲+另类+欧美+变态 | 国产乱淫av | 粉嫩aⅴ一区二区三区四区五区 | 中文在线免费观看 | 少妇太爽了 | www.中文字幕在线观看 | 一起操在线观看 | 亚洲欧美国产毛片在线 | 胸大被男同桌强解开胸罩床吻 | 日本少妇吞精囗交 | av小说天堂网 | 少妇邻居做爰5 | www香蕉| 国产+高潮+白浆+无码 | 天堂毛片| 一本一道人人妻人人妻αv 男人日女人b视频 | 99久久国产视频 | av电影在线观看网址 | 大学生三级中国dvd 三级黄色短视频 | 国产人成一区二区三区影院 | 男人和女人日b视频 | 久久久一级片 | 亚洲jizzjizz日本少妇 | 办公室大战高跟丝袜秘书经理ol | www.五月激情| 天天插天天色 | 在线观看你懂 | 亚洲色图欧美在线 | 圣女被打开双腿触手调教视频 | 国产免费久久 | 日韩av电影院 | 小泽玛利亚一区二区三区视频 | 久久大胆 | 成人交配视频 | 国产精品久久久久久无人区 | 看片一区| 全黄一级男人和女人 | 天天爽夜夜爽夜夜爽 | 美女网站黄页 | 亚洲成人毛片 | 亚洲欧美综合视频 | 日韩欧美91 | 少妇精品 | 久草综合在线视频 | 国产精品第一 | 91色站| 久久九九久久九九 | 亚洲精品四区 | 性xxxx视频 | 国产精品2019 | 漂亮的岳hd中文字幕 | 播放毛片| 久久综合五月天 | 亚洲精品日韩av | 黄a在线| 日韩三级在线免费观看 | 日日操影院 | 少妇进去了就不反抗了 | 男生操女生免费网站 | 久久另类ts人妖一区二区 | 日韩在线视频不卡 | 潘金莲一级淫片 | 国产精品久久久久久久久久妞妞 | 黄色三级视频 | ffee性xxⅹ另类老妇hd | 仓库糟蹋丰满少妇 | 免费亚洲视频 | 亚洲视频网站在线观看 | 两根一起进蹂躏3p | 亚洲视频一区二区 | 国产婷婷| 我和漂亮女邻居做爰5 | 精品午夜福利在线观看 | 视频在线免费 | 香蕉视频免费在线观看 | 国产在线一级 | 91啪在线| 少妇被躁爽到高潮无码人狍大战 | 欧美极品视频 | 性chinese极品按摩 | 免费一区二区在线观看 | 名校风暴在线观看免费高清完整 | 凸凹视频在线观看 | 欧美疯狂做受xxxxx高潮 | 成人在线观看一区二区三区 | 视频一区日韩 | 午夜影院黄色 | 人人插人人插 | 97自拍| 91搞搞 | 五月天激情开心网 | 丁香啪啪 | 自拍三级 | 久久免费视频观看 | 亚洲精选一区二区三区 | 99久久精品国产一区二区三区 | 亚洲少妇一区二区三区 | 国产老女人乱淫免费 | 黄色激情视频在线观看 | 国产一区二区三区四 | 色01看片网| 日韩午夜剧场 | 亚洲精品久久久久avwww潮水 | 欧美国产在线观看 | 国产精品人成在线观看免费 | 538在线精品视频 | 四虎在线观看视频 | 亚洲精品乱码久久久久久久久久久久 | 动漫一区二区三区 | 在线免费观看黄视频 | 亚洲第一黄色 | 欧美猛交免费 | 久久99精品久久久久久琪琪 | 娇妻张妍交换高潮 | 麻豆国产一区二区三区四区 | 中国一级黄 | 99性趣网 | 草莓视频在线观看污 | 亚洲欧美国产精品专区久久 | 天天爽天天摸 | 国产99久久九九精品无码免费 | 色片在线播放 | 成人精品免费 | 欧美作爱视频 | 亚洲天堂av电影 | 精品国产麻豆 | 午夜视频福利在线观看 | 一本大道久久久久精品嫩草 | 快色在线观看 | 被夫上司蹂躏的七天七夜在线观看 | 思思精品视频 | 国产精品无码在线播放 | 午夜欧美视频 | yy7777777少妇光屁股 | 成人深夜网站 | 青青草成人网 | 国产日韩欧美高清 | 天天操人人 | 亚洲av成人无码一二三在线观看 | 影视一区二区三区 | av中文字幕在线看 | 性生交大全免费看 | 国产精品电影 | 免费看女生隐私 | 天天操狠狠操 | 中文字幕在线播放视频 | 在线高清av | 视频在线观看一区二区 | 第四色成人网 | 日韩精品专区 | 黄色成人免费视频 | 精品人伦一区二区三区 | 波多野结衣av电影 | 日日骚av| 中文字幕网址 | 女乡长的太紧太深了在线观看 | 亚洲黄色在线观看视频 | 97在线视频免费观看 | 91老师片黄在线观看 | 亚洲成人7777 | 久久国产精品免费视频 | 国产一级一片免费播放 | 精品国产免费观看 | 中文字幕久久网 | 人人妻人人澡人人爽人人欧美一区 | 五月天国产 | 欧美熟妇另类久久久久久不卡 | 性色av网站 | 色婷婷伊人 | 91麻豆国产精品 | 女人天堂网 | 欧美激情在线免费观看 | 免费福利影院 | 911美女片黄在线观看游戏 | 日韩一级在线 | 97伊人 | 色欲av伊人久久大香线蕉影院 | 成人福利在线视频 | av免费一区 | 亚洲黄色三级视频 | 久久精品国产99 | 大尺度舌吻呻吟声 | 综合网亚洲 | 黄色漫画网站 | 国产三级电影网 | 国产精品二区在线观看 | 亚洲h视频| 亚洲久久天堂 | 欧美日本在线视频 | 免费黄色日本网站 | 欲色天天 | 五月亚洲综合 | 日韩一区高清 | 在线免费观看一级片 | 日批的视频 | 美女爆吸乳羞羞免费网站妖精 | 成人资源在线观看 | 口述被爽到呻吟高潮自述 | 国产精品高潮呻吟久久久 | 2019最新中文字幕 | 国产小视频在线看 | 侏儒人被黑人蹂躏mp4 | 91成人免费在线观看 | 无码人妻丰满熟妇啪啪网站 | 91高清视频在线观看 | 亚洲va在线| 国产欧美日韩亚洲 | 日本在线小视频 | 欧美mv日韩mv国产 | 国产乱码77777777 | 黄色三级在线播放 | 日韩一区二区三区在线视频 | 这里只有精品9 | 免费观看黄色大片 | 伊人夜夜躁av伊人久久 | 国产精品国产精品 | 午夜性色福利视频 | 亚洲成人网在线观看 | 一区二区三区国产在线观看 | 人妻中文字幕一区二区三区 | www.激情五月 | 天天躁夜夜躁狠狠躁av | 182tv线路一 成年视频在线观看 | 羞耻调教憋尿(高h,1v1) | 日韩jizz | 日韩欧美精品 | 91青青操 | 亚洲va久久久噜噜噜久久 | 青青草视频| 黄色wwww | 中文字幕人妻一区二区在线视频 | 献给魔王伊伏洛基亚吧动漫在线观看 | 好男人资源 | 污视频免费网站 | 国产毛毛片 | 青楼女人绝活免费观看电视剧完整版 | 姐妹5免费观看完整 | 污片网站在线观看 | 国产美女免费视频 | 电影一区二区三区 | 亚洲av成人无码网天堂 | 欧美亚洲激情 | 在线观看免费 | 国产深夜福利 | 中文字幕人妻一区二区在线视频 | 成人午夜又粗又硬又大 | 日韩国产精品一区 | a天堂在线观看 | 欧美中文字幕在线视频 | 亚洲精品成人无码 | 国产传媒av | www.成人在线观看 | 情趣调教喷水h | 久久永久免费 | 女人的超长巨茎人妖3d | 香蕉视频免费在线观看 | 欧美黑人xxxx | 午夜免费毛片 | 一区二区福利视频 | 超碰97av| 中国特级毛片 | 丰满尤物白嫩啪啪少妇 | 亚洲人xxx日本人18 | 日本变态折磨凌虐bdsm在线 | 欧美激情不卡 | 国产一区二区三区四区视频 | 女人下边被添全过视频 | 国产九区 | 六月婷婷综合 | 精品午夜福利在线观看 | 天堂av中文| 大尺度做爰呻吟舌吻 | 九九成人 | www网站在线免费观看 | 日本国产精品 | wwww日本60| 色综合av| 性xx紧缚网站 | 色婷婷成人网 | 亚洲成人精品一区二区三区 | 这里只有精品9 | 九色视频在线观看 | 成人黄色在线视频 | 亚洲精品水蜜桃 | 毛片a级片| 嗯~啊~快点死我漫画 | 一卡二卡三卡四卡五卡 | 黄色一级网站 | 91久久精品一区二区三 | 免费黄色看片网站 | 黄色无遮挡网站 | 人妻中文字幕一区二区三区 | 欧美成人一区二区三区在线观看 | 韩国三级电影中文字幕 | 成人福利在线视频 | www.com捏胸挤出奶 | 色哟哟中文字幕 | 欧美精品久久96人妻无码 | 岛国av大片 | 日韩av一级 | 久久久青青 | 成年黄色网 | 少妇精品 | 亚洲一区人妻 | 五月综合视频 | 猛男办公室大战狂4p | www.天天射 | 麻豆久久久久久 | 色老头影视 | 视频在线观看一区二区 | 亚洲综合av网 | 日韩三级中文 | 成年人免费看视频 | 亚洲大片网站 | 经典一区二区三区 | 名校风暴在线观看免费高清完整 | 深夜网站在线观看 | 国产1页 | 一级片在线观看免费 | 亚洲精品久久久久中文字幕二区 | 黄色小说软件 | 农民工hdxxxx性中国 | 可以在线看的av | 黄色精品网站 | 北条麻妃一区二区三区 | 91免费观看视频 | 国产高清小视频 | 色播导航| 午夜有码 | 91色片| 3级毛片| 久久综合av| 丰满熟女人妻一区二区三区 | 亚洲精品国产精品乱码不卡 | 欧美性猛交7777777 | 亚洲国产成人综合 | 潘甜甜在线 | 国产精品爽 | 国产小u女发育末成年 | 插得好舒服 | 污网站免费观看 | 日本韩国在线观看 | 欧美毛片视频 | 成人福利免费视频 | 国产香蕉视频在线播放 | 在线观看三级视频 | 激情小说综合 | h文网站 | 国产又黄又粗又猛又爽 | 求欧美精品网址 | 日韩色图在线观看 | 日日夜夜爽爽 | 91九色视频在线观看 | 黄色激情视频在线观看 | 顶级毛片 | 无码视频在线观看 | 99国产精品久久久久久久久久久 | 黄色在线小视频 | 短裙公车被强好爽h吃奶视频 | 亚洲精品一二三四 | 91精品国产综合久久久蜜臀九色 | 国产av无码专区亚洲av毛片搜 | 在线观看网页视频 | japanese在线观看 | 亚洲天堂av电影 | 国产高清小视频 | 国产性hd | 黄色三级视频 | 亚洲精品色图 | 国产九区 | 成人免费看片在线观看 | 国产区在线| 女m被s玩胸虐乳哭着求饶 | 欧美在线播放 | 国产三级精品视频 | 极品女神无套呻吟啪啪 | 午夜国产视频 | 越南黄色片 | 日本成人网址 | 欧美一区二区三区免费视频 | 罗宾被到爽高潮痉挛 | 亚洲成人av一区 | 久久久久在线 | 台湾三级台湾三级dvd影视 | 美女靠逼视频 | 成人三级在线观看 | 老熟妇精品一区二区三区 | 99国产精品久久久久久久久久久 | 日韩精品久久久久久 | 亚洲美女久久久 | 99热这里只有精品5 综合久久久久久久 | 国产精品无码永久免费不卡 | 日韩av高清在线观看 | 国产在线视频卡一卡二 | 黄黄的视频 | 亚色图 | 精品黑人一区二区三区在线观看 | 触手动漫| 看免费毛片 | 欧美极品一区二区 | 少妇久久久久久 | 国产在线观看第一页 | 日本高清有码 | 成人免费福利 | 影音先锋一区二区三区视频 | 国产六区 | 米奇影音 | 欧美激情五月 | 在线观看免费福利 | 欧美a级免费| 欧美理伦 | 无人高清电视剧在线观看直播动漫 | 成人黄色在线观看 | 欧美日韩在线一区二区三区 | 欧美一二区视频 | 白丝女仆被免费网站 | 久久精品国产亚洲AV无码男同 | 成人一二区| 91搞搞| 精品欧美一区二区精品久久 | 欧美卡一卡二 | gogogo高清国语完整 | 欧美成人a| 女人的超长巨茎人妖3d | 久久久久女人精品毛片九一 | 国产精品毛片一区二区三区 | 色哟哟一区二区 | 日韩伦理中文字幕 | 国产原创popny丨九色 | 欧美最猛黑人xxxx黑人猛交 | 在线免费观看日韩av | 9.1人网站免费 | 四虎永久网址 | 激情图片在线视频 | 五月激情丁香 | 99热欧美 | 国产精品熟女一区二区不卡 | 黑人操少妇 | 国产伦精品一区二区三区免.费 | 91久久电影 | 青青草成人av | 国产成人精品自拍 | 午夜伦情 | 绯色av一区二区 | 日本护士毛茸茸体内精 | 狠狠cao日日穞夜夜穞av | 3级黄色片| sleepless动漫在线观看免费播放 精品视频三区 | 美女靠逼视频 | 国产国产国产 | 国产精品熟女一区二区不卡 | 69视频免费| 午夜电影一区二区三区 | 青青草中文字幕 | 成人在线观看网站 | 成人久久精品人妻一区二区三区 | 日韩成人免费观看 | 五月婷婷激情综合网 | 涩涩的动漫 | 国产精品久久久久一区 | 触手动漫 | 丰满熟妇人妻中文字幕 | 美女爆吸乳羞羞免费网站妖精 | 日韩无码精品一区二区三区 | 成人在线观看网站 | 美女主播福利视频 | 爱爱中文字幕 | 亚洲黄色网址 | 梦梦电影免费高清在线观看 | 手机av免费| 按摩害羞主妇中文字幕 | 91色交视频 | 国产午夜三级一区二区三 | 日本少妇xxxx动漫 | 国产1页| 成人黄色免费在线观看 | 大尺度做爰呻吟舌吻 | 日本三级人妇 | 小向美奈子在线观看 | 免费激情视频网站 | 最新中文字幕在线观看 | 啪啪自拍 | 四虎免费看黄 | 少妇av一区二区三区 | 日本乱子伦| 一区二区日韩精品 | 国产精品88| 欧美三级电影在线 | 插吧插吧综合网 | 波多野结衣三级 | 国产精品, | 人妻中文字幕一区二区三区 | 女m被主人虐玩调教91 | 精品肉丝脚一区二区三区 | 天天综合永久入口 | 亚洲视频在线免费播放 | 久久亚洲国产 | 大黑人巨大荫蒂大交女人 | 亚洲成人免费在线 | 亚洲一卡二卡三卡 | 亚洲一二三四 | 成人h视频 | 96日本xxxxxⅹxxx70| 少妇人妻偷人精品无码视频新浪 | 黄色片在线视频 | 免费毛片网站 | 性生活一级视频 | 国产强伦人妻毛片 | 久久机热 | 国产在线中文字幕 | 激情综合激情五月 | 91福利在线观看 | 国产视频99 | 欧美日韩高清一区二区 | 天天操天天射天天 | 最新中文字幕在线 | 极品女神无套呻吟啪啪 | 永久免费成人代码 | 欧美一级特黄视频 | 添女人荫蒂视频 | 国产精品suv一区 | 夜夜骚av一区二区三区 | 丰满少妇被猛烈进入 | 撸撸在线视频 | 五月婷婷六月色 | 91老师片黄在线观看 | 不卡日韩 | 免费中文字幕 | 制服丝袜在线一区 | 山口珠理av| 国产免费黄色小说 | 激情高潮呻吟抽搐喷水 | 亚洲香蕉 | 丝袜天堂 | china18hdxxxx中国 国产黑丝一区 | 国语一区 | 国产性生活| 超碰九七 | 嗯~啊~快点死我小说 | 毛片毛片毛片毛片 | 中文字幕福利视频 | 国产系列精品av | av电影日韩 | 国产精品高清网站 | 欧美猛交免费 | 欧美一二区视频 | 宝贝乖h调教灌尿穿环 | 特级黄色大片 | 精品视频一区二区 | 天天爱天天射 | 黄色精品视频 | 脱了内裤互相蹭很舒服 | 国产伊人久久 | 黄色大毛片 | 99热成人 | 黄黄的视频 | 九九久久精品视频 | 国产精品二区在线观看 | 亚洲jizzjizz日本少妇 | 亚洲成人高清在线 | 国产毛片毛片毛片 | 四虎一区二区 | 一级做a视频 | 国产一区在线视频 | 麻豆精品一区二区三区视频 | 久久久天堂 | 一级特黄色 | 欧美香蕉视频 | 欧美草逼网 | 国内精品久久久久 | 狠狠婷婷 | 色吧综合| 日韩中文字幕电影 | h文在线观看 | 两个男人躁一个女人免费视频 | 乳色吐息在线观看 | 日韩爱爱视频 | 少妇媚药按摩中文字幕 | av自拍网 | 国产欧美a| 上司出差调教秘书hd | 国产黄色在线观看 | 久久精品毛片 | 欧美在线中文 | 色婷婷基地 | 女人天堂网 | 国产一区二区精品丝袜 | 黄视频免费在线观看 | 午夜久久电影 | 91精品免费视频 | 男生桶女生鸡鸡 | 男同小说肉文 | 中文字幕成人在线 | 国产一卡二卡三卡 | 美女啪啪网 | 97在线观看视频 | 色天堂视频 | 日韩色图在线观看 | 日韩淫片 | 国产一级一片免费播放 | 婷婷九月 | 婷婷激情综合网 | 日日插插| 天堂中文字幕免费一区 | 日韩电影一二三区 | 成年女人免费视频 | 岛国一级片 | 中文在线中文资源 | 中文字幕二区三区 | 欧美六区| 无码人妻精品一区二区蜜桃色欲 | 精品视频在线播放 | 日韩av中文字幕在线播放 | 免费黄色看片网站 | 小辣椒福利视频导航 | 久久激情综合 | 久久私人影院 | 久操国产视频 | 黄色777| 成人日批视频 | 疯狂撞击丝袜人妻 | 亚洲熟女乱色一区二区三区久久久 | 激情网站在线观看 | 国产人妻一区二区 | 538在线精品视频 | 西西人体44 | 中文字幕观看在线 | 嗯~啊~快点死我漫画 | 免费黄色成人 | 一级黄色录像带 | 免费福利视频网站 | 悠悠av| 欧美成年人 | 亚洲一区欧美激情 | 国产黄片一区二区三区 | 在线天堂中文在线资源网 | 制服.丝袜.亚洲.中文.综合懂 | 一区二区日韩精品 | 国产在线一级 | 午夜影院操| 国产精品v亚洲精品v日韩精品 | 免费看黄色av | 免费毛片网站 | 亚洲天天在线 | 涩涩天堂 | 国产三级视频在线 | 乖乖女的野男人们np | 欧美bbbbbbbbbbbb18av | 九色91 | 黑丝一区 | 中文字幕一二三区 | 国产夫妻在线 | 少妇高潮露脸国语对白 | 黄色天堂网 | 欧美在线影院 | www日本视频 | 人人插人人射 | 97国产精品视频人人做人人爱 | 中文字幕人妻一区二区在线视频 | 成人性生交大片 | 久草综合在线视频 | 国产精品久久久久久久成人午夜 | 欧美一区二区激情视频 | 国产经典三级 | 97人妻精品一区二区三区视频 | 亚洲草逼 | 不卡中文 | 超碰在线人人艹 | 日韩黄色片 | 色01看片网| 内衣办公室第一集 | 天天超碰 | 亚洲丁香| 日韩深夜视频 | 国产av无码专区亚洲a∨毛片 | 中文字幕专区 | 91在线一区 | 精品小视频 | 大黑人巨大荫蒂大交女人 | 91动画| 国产免费一区二区三区在线观看 | 国产美女免费视频 | 97自拍 | 顶级毛片| 中文字幕观看在线 | 国产一区二区三区四区在线观看 | 91ts人妖另类精品系列 | 日韩天天干 | 亚洲一级电影 | 天天做天天干 | 福利第一页 | 欧美freesex黑人又粗又大 | 免费在线看黄网站 | www.免费av| 爱情岛论坛永久入址测速 | 娇bbb搡bbbb揉bbbb| 精品国产乱码久久久久久郑州公司 | 国产男男gay| 另类一区二区三区 | 香蕉视频在线网站 | 男人j进入女人j内部免费网站 | 小舞被调教成奶奴魅魔视频 | 日韩jizz | 岛国一级片 | sm在线播放| 91精品国产综合久久久蜜臀 | 日日夜夜狠狠干 | av天天有| 奇米狠狠操 | 国产在线视频导航 | 欧美成人一级 | 中文字幕无人区二 | 色综合天天综合网天天狠天天 | 亚洲xxxxxx | 国产一级一片免费播放 | √天堂资源地址在线官网 | 尻逼视频网站 | 97人人射 | 日韩欧美日本 | 女攻总攻大胸奶汁(高h) | 日韩久久久 | 午夜不卡av | 国产农村av | 日本一区二区三区在线免费观看 | 我把护士日出水了视频90分钟 | 极品白嫩少妇无套内谢 | 美女露乳 | 日韩精品999| 欧美级毛片 | 国产黄片一区二区三区 | 白浆四溢 | 免费的黄色小视频 | 日韩色av | 欧美春色 | 国产精品1 | 欧美日韩中 | 日本一区二区三区在线播放 | 欧美极品少妇xxxxⅹ喷水 | 日韩精品久久久久久 | 亚洲欧美另类在线观看 | 又色又爽又黄gif动态图 | 欧美a大片 | 亚洲人毛茸茸 | 特一级黄色片 | 亚洲拍拍 | 久久黄色录像 | 免费无遮挡网站 | av老司机在线 | 福利视频在线看 | 爱豆国产剧免费观看大全剧集 | 波多野结衣视频在线播放 | 亚洲精品成人在线视频 | 91视频大全| 中国女人特级毛片 | 性欧美又大又长又硬 | 国产99久久久国产精品成人免费 | 奇米狠狠操 | 亚洲欧美国产精品专区久久 | 国产精品自产拍高潮在线观看 | 国产91在线播放 | 国产欧美a | 九九色视频 | 东京干导航 | 免费中文字幕在线观看 | 艳母视频在线观看 | 国产绿帽一区二区三区 | 九九小视频 | 夫妻性生活网站 | 超碰人人人人人 | 波多野结衣 一区 | 成人免费网站视频 | 秋霞一区二区 | 国产精品成人免费 | frxxeexxx麻豆hd | 日本黄色大片网站 | 在线观看网页视频 | 最新av观看 | 老色鬼在线 | 美女脱了内裤喂我喝尿视频 | 她享受粗啪滋嗯大爷轻点视频 | 中文字幕一区2区3区 | 成人久久精品人妻一区二区三区 | 国产人妻一区二区 | 国内黄色片 | 大伊人网| 久久久久成人精品无码 | 奇米影视在线播放 | 亚洲精品乱码久久久久久久久久久久 | 午夜伦情 | 插插插插插插插插插插 | xxxx在线播放 | 伊人久久综合视频 | 武则天一级淫片高清免费观看 | 久久久噜噜噜久久久 | 成人天堂 | 亚洲精品一区二区三区区别 | 欧美另类极品videosbest使用方法 | 中出在线观看 | 国产成人无码www免费视频播放 | 欧美日韩久久久 | 黄色大片儿. | 夜夜夜影院 | 亚洲精品一区二区在线 | 重口味av| 亚洲熟女乱色综合亚洲小说 | 日本黄页网 | 毛片高清 | 国产精品熟女视频 | 亚洲国产精品免费 | 五十路av | 阿v免费视频 | 国产原创视频 | 免费看黄av | 国产青青视频 | 口述我的初苞被强开 | 一区二区免费在线观看 | 黄色污污视频在线观看 | 国产伦精品一区二区三区免.费 | 人妖视频网站 | 中文字幕亚洲综合 | 99色综合 | h片在线免费观看 | 成人av观看 | gay男互凵gay男同偷精 | 天天色综合av | 特级黄色录像 | 色偷偷网站 | 国产片网站 | 最新av女优 | 中文字幕在线观看一区 | 午夜视频免费 | 欧美久久精品 | 不卡视频在线播放 | 秋霞午夜鲁丝一区二区老狼 | 日本美女一级片 | 少妇精品偷拍高潮白浆 | 性教育av| 午夜有码 | 伊人久久艹 | 亚洲欧洲在线播放 | 91av免费看| 国产手机av | 另类尿喷潮videofree | 欧美日韩国产中文字幕 | 99色综合| 国产男女猛烈无遮挡免费视频动漫 | bl无遮挡高h动漫 | free性丰满hd性欧美4k | 爱的人电影全集免费观看 | 日本h片 | 国产一区久久 | 欧美大片高清免费观看 | 奇米四色7777 | 色播视频在线观看 | 男人j进入女人j内部免费网站 | 亚洲久久色 | 欧美在线免费观看 | 黄色网址视频 | 无码人妻精品一区二区三应用大全 | 亚洲国产不卡 | 一级少妇片 | 国语一区 | 男人天堂2024 | 在线电影一区 | 精品国产乱码久久久久久郑州公司 | 91在线网站 | 亚洲经典av | 日韩精品一区二区三区四区五区 | 人人妻人人澡人人爽人人欧美一区 | 中文字幕乱码无码人妻系列蜜桃 | 西欧free性满足hd4k | 国产欧美在线看 | 包玉婷被绑在床扒衣虐调教 | 国产日韩三级 | 一卡二卡在线 | 神秘电影永久入口 | 男人天堂2021 | 国产精品久久久久久一区二区三区 | 侵犯小太正gay初精视频 | 黄色a网站| 波多野结衣一区二区三区四区 | 调教撅屁股啪调教打臀缝av | 日本久久精品视频 | 放荡青春 | 欧美做受 | 永久免费在线视频 | 日本变态折磨凌虐bdsm在线 | 国产情侣小视频 | 超碰最新网址 | 国产办公室系列 | 亚洲激情久久 | 99毛片 | 日韩专区欧美专区 | 日韩av免费网站 | 成人一二三四区 | 中国女人内射6xxxxx | 加勒比色综合 | 黑白配在线观看免费观看 | 亚洲爽爽网 | 成人三级在线观看 | 少妇av一区二区三区 | 污污的视频软件 | 天堂网亚洲 | 裸体女人免费视频 | 99国产精品一区 | 午夜黄色小说 | 丰满大乳露双乳呻吟 | 久久免费国产视频 | 激情欧美一区二区 | 91精品国产综合久久久久久 | 人妻无码一区二区三区免费 | 久久免费视频观看 | 乱淫视频 | 成人激情视频在线 | 小泽玛利亚一区二区三区视频 | 婷婷成人在线 | np视频| 在线播放av网址 | 捆绑美女调教 | 人人妻人人澡人人爽精品日本 | 日韩三级电影网站 | 性欧美精品中出 | 成人性电影 | a亚洲天堂 | 色噜噜狠狠一区二区三区果冻 | 久久久精品福利 | 被闺蜜玩sm(女绑女) | 成年人性生活片 | 女人的超长巨茎人妖3d | 夜夜干天天操 | 丰满熟妇人妻中文字幕 | avapp在线观看 | 扒开双腿猛烈地灌满精子男男 | 污污网站在线 | 少妇一级淫片免费放播放 | 欧美大片免费高清观看 | 在线观看国产黄 | 制服.丝袜.亚洲.中文.综合懂 | 51精品国产 | 少妇被挠肉丝脚心vk | 免费在线观看毛片 | 我和岳交换夫妇爽4p晓娟小说 | 日本高清有码 | 国产精品美女毛片真酒店 | 亚洲无人区码一码二码三码的含义 | 好吊色视频988gao在线观看 | 国产成人精品自拍 | mm131丰满少妇人体欣赏图 | 91精品久久久久久久99蜜桃 | 玖玖在线 | www.国产免费| 少妇又紧又色又爽又刺激视频 | 成人天堂| 欧美无砖砖区免费 | 国产午夜福利精品 | 麻豆久久久久久 | 写真福利片hd在线播放 | 欧美激情图区 | 成人在线观看一区二区三区 | 国产ts丝袜人妖系列视频 | 两个小y头稚嫩紧窄h文 | 成人综合激情网 | 亚洲美女久久久 | 欧美午夜精品久久久久久人妖 | 黄色三级在线播放 | 日本成片网 | 亚洲国产网站 | 日日骚av | 亚洲精品免费在线观看 | 爱爱免费网站 | 超碰免费91 | 在线国产精品视频 | 国产每日更新 | 精品小视频 | 天天天天躁天天爱天天碰2018 | 久久综合九色综合欧美狠狠 | 国产视频二 | 国产资源视频 | 91亚色在线观看 | 亚洲熟女乱色综合亚洲小说 | 九九热精品免费视频 | 色丁香色婷婷 | gogogo日本免费观看电视剧最 | 欧美另类xxxx | 欧美视频在线观看一区二区 | 健身教练巨大粗爽gay视频 | 同人动漫在线观看 | 男人j捅女人p | 国产精品成人在线 | 公和我乱做好爽添厨房中文字幕 | 久久精品国产亚洲a | 五月婷久久 | 欧美熟妇另类久久久久久不卡 | 爱爱福利社| 婷婷啪啪| 亚洲草逼 | 国产又黄又粗又猛又爽 | 中文字幕专区 | 精品国产乱码久久久久久婷婷 | gay男互凵gay男同偷精 | 91香蕉国产在线观看软件 | 综合网亚洲 | 精品黑人一区二区三区在线观看 | 日韩色图视频 | 99久久国产视频 | 九九热精品在线 | 亚洲欧美综合网 | 色戒电影未测减除版 | 丁香啪啪 | 男女插插视频 | 亚洲欧美另类在线视频 | 久久精品丝袜高跟鞋 | 久操视频在线免费观看 | 亚洲第一大网站 | 国产成人欧美 | 色播视频在线观看 | 欧美中文字幕在线视频 | 美女露胸100%无遮挡 | 蜜桃一区二区三区 | 国产成人综合视频 | 在线看中文字幕 | 67194国产 | 丁香婷婷网 | 亚洲成人视屏 | 少妇真人直播免费视频 | 长篇武侠肉伦小说 | 国内精品视频在线观看 | 免费黄色看片网站 | 亚洲一区二区三区中文字幕 | 孕交videos小孕妇xx另类 | 免费黄色av电影 | 欧美a级免费 | 日韩三级伦理 | 日韩视频一区二区在线观看 | 天堂在线中文 | 国产精品伦子伦免费视频 | 国产精品毛片一区二区三区 | 色欲av永久无码精品无码蜜桃 | 久久久久在线 | 51免费看成人啪啪片 | 男人天堂网av | 美日韩一区二区 | 他揉捏她两乳不停呻吟视频 | 人妻一区在线 | 人人澡人人干 | 91看片淫黄大片91桃色 | 久久久久噜噜噜亚洲熟女综合 | xxxx69美国 | 国内精品免费视频 | 亚洲精品一区二区三区四区高清 | 久久久999精品 | 日本高清视频一区 | 日剧电影大尺度免费完整版 | 波多野结衣av电影 | 婷婷激情综合 | 久久久精品网 | 夜夜夜影院 | 一本大道久久久久精品嫩草 | 欧美高h | 激情网站在线观看 | 天天射网站 | 91超碰免费 | 亚洲免费福利视频 | 四虎在线观看视频 | 30一40一50老女人毛片 | 日本欧美黄色 | 日本免费福利视频 | 午夜影院在线观看18 | 精品一区二区三区在线视频 | 在线h网站 | 国产在线免费 | 成人特级片 | 月色导航 | 欧美大片高清免费观看 | 插入阴道视频 | 91色站| 国产综合在线视频 | 可以直接看的毛片 | 吊侵犯の奶水授乳羞羞漫画 | 人妻精品一区二区三区 | 97精品久久| 人妻中文字幕一区二区三区 | 亚洲人xxx | 色屁屁网站 | 国产人妻精品一区二区三区不卡 | 毛片视频在线免费观看 | 日韩a| 国产精品二区在线观看 | 日韩免费视频观看 | 久久久久久久久久国产 | 亚洲黄色在线观看视频 | 91少妇丨porny丨 | 成人免费版欧美州 | av一区二区三 | 国产精品无码免费播放 | 最新中文字幕在线 | av激情网站| 天堂婷婷| 国产成人综合视频 | 成人av一区二区三区在线观看 | 国产三级三级在线观看 | 嫩草嫩草嫩草嫩草嫩草嫩草 | 亚洲成人毛片 | 国产一级视频 | 日本公妇乱偷中文字幕 | 日韩成人午夜电影 | 黄色激情小说视频 | 一级片黄色录像 | 男人猛吃奶女人爽视频 | 漂亮的岳hd中文字幕 | 高h喷水荡肉爽文1v1沉芙 | 免费成人短视频 | 成人网站免费观看 | 亚洲精品一区二区三区四区高清 | 日韩久久久久久久久久 | 成人免费无遮挡无码黄漫视频 | 圣女被打开双腿触手调教视频 | 萌白酱福利视频 | 操丝袜少妇 | 欧美日韩大片 | 国产精品丝袜 | 我想看毛片 | 精品一区二区三区在线视频 | 国产精品www色诱视频 | 国产夫妻视频 | 日韩孕交 | 国语对白av | 日韩欧美福利视频 | 日本免费福利视频 | 男生桶女生鸡鸡 | 国产福利合集 | 日韩天堂av | 甘婷婷全部三级裸体电影 | 欧美最猛性xxxxx(亚洲精品) | 少妇人妻精品一区二区三区 | 国产精品久久久久久精 | 欧美一二区视频 | 国产精品夜夜爽张柏芝 | 国产精品网址 | 欧美精品国产精品 | 一级黄色影视 | 圣女被打开双腿触手调教视频 | 久久久一级片 | 做爰全过程叫床视频 | 很污的网站 | 特级西西人体444www高清大胆 | 中文久久 | 中文字幕无产乱码 | 国产精品无码AV | 美女视频污 | 在线视频导航 | 四虎免费看黄 | 亚洲午夜精品久久久久久浪潮 | 天干夜夜爽爽日日日日 | 丨国产丨调教丨91丨 | 甘婷婷全部三级裸体电影 | 久免费一级suv好看的国产 | 欧美精品在线一区 | 男的艹女的视频 | xxxx69美国 | 日本成人一级片 | 成人久久久精品乱码一区二区三区 | 91九色视频在线观看 | 波多野结衣三级 | 懂色av懂色av粉嫩av分享吧 | 高跟鞋和丝袜猛烈xxxxxx | 欧美亚色| 偷偷在线观看免费播放电视剧大全 | 男女啪啪小视频 | 中文字幕网址 | 91精品91久久久中77777 | 伊人欧美 | 亚洲第一男人天堂 | 欧美在线中文 | h双腿涨灌触手play慎入视频 | 啊啊啊快高潮了女视频 | av资源网址| 色欧美视频 | 国产精品天天狠天天看 | 视色视频| 免费福利影院 | 无码人妻丰满熟妇精品 | 亚洲欧洲日韩综合 | 91超碰免费| 性满足bwbwbwbwbw | 上司出差调教秘书hd | 91香蕉在线| 人妻熟女一区二区aⅴ水 | 黄色不卡视频 | 91香蕉在线 | 天天久久综合 | 亚洲国产视频一区 | 国产专区一 | 欧美一区日韩一区 | 国产精品自产拍高潮在线观看 | 美女主播福利视频 | 精品亚洲一区二区三区四区五区 | 午夜伦伦| 被陌生人强痴汉h | 国产精品久久久久久久久久妞妞 | 男女91视频| a片在线免费观看 | 触手动漫| 色婷婷久久综合 | 自拍偷拍p| 猛男裸体xvideoscom | 五月天天色 | 思思在线视频 | 色涩综合| 久久一本 | 国产精品久久久久久久成人午夜 | 91人人干 | 可以免费看av | 精品视频久久久 | 欧美大片一区二区 | 91高清视频在线观看 | 欧美激情视频一区二区三区 | 国产又粗又猛又黄又爽的视频 | 欧美高清69hd | 91免费网 | 久久久久久久久久免费视频 | 一级美女视频 | 亚洲精品一区二区三区在线 | 寂寞主妇的肉体满足 | 欧美a级免费| 亚洲国产精品久久久久 | 北条麻妃青青久久 | 99re在线观看 | www狠狠| 色姑娘综合 | 九色视频在线观看 | 西西人体做爰大胆gogo | 国产午夜精品一区二区三区视频 | 精品1区2区3区| 性吧av| 国产人妻精品一区二区三区不卡 | 亚洲欧美另类自拍 | 深夜福利网站 | 丰满熟女人妻一区二区三 | 日本在线免费视频 | 久久久久国产精品人妻aⅴ院 | 亚洲九九| 国产精品第100页 | 老师露出强行让男生揉动漫 | 美女热逼| 亚洲a视频 | 久久精品视频在线 | 欧美色图首页 | 日本久久久久久 | 国产一区二区三区四区精 | 国产在线视频卡一卡二 | 日日天天干 | 亚洲欧美另类在线视频 | 欲奴性猛交3未删减 | 在线看黄网 | 国产成人在线免费 | 俄罗斯av在线 | 亚洲午夜精品视频 | 仓库糟蹋丰满少妇 | 国产精品一区二区人妻喷水 | 短裙公车被强好爽h吃奶视频 | 大香伊人 | 免费99精品国产自在在线 | 久草毛片 | 色播5月天 | 国产一卡二卡三卡 | 亚洲一区二区三区视频 | 久久艳片www.17c.com| 揄拍自拍 | 色噜噜狠狠一区二区三区果冻 | 双腿打开揉弄高潮 | www色中色 | 在线观看你懂 | 视频在线观看 | 沈悦高志欣 沈镇南原著小说 | 国产精品无码一区二区三区 | 沈悦高志欣 沈镇南原著小说 | 先锋资源中文字幕 | 我爱av好色| 久久ww | 亚洲一区在线播放 | 黑白配在线观看免费观看 | 国产一区二区三区免费视频 | 男女交性视频播放 | 日日操影院 | 亚洲色p| 成人免费毛片w下载 | 国产特黄| 色婷婷综合久色aⅴ五区最新 | 中文字幕一区二区三区四区五区 | 欧美日韩一区二区三区在线电影 | 福利精品| 欧美疯狂做受xxxxx高潮 | 国产在线中文字幕 | 伊人青青草原 | 在线观看超碰 | 国产福利一区二区 | av导航在线观看 | 国产欧美日韩亚洲 | 天堂8在线视频 | 国产精品一区二区三 | 国产欧美a | 国产91在线播放 | 国产精品不卡在线观看 | 中国女人内射6xxxxx | 国模无码视频一区 | 不卡日韩 | 触手动漫| 丝袜脚交免费网站xx | av电影资源 | 中文字幕在线观看线人 | 国产日韩在线播放 | 大黑人巨大荫蒂大交女人 | 古装做爰无遮挡三级聊斋艳谭 | 丁香综合网 | 国产精品久久久久久久久久妞妞 | 久草视频观看 | 国产小u女发育末成年 | 一本大道久久久久精品嫩草 | 亚洲成人黄色影院 | 婷婷激情综合网 | free性满足hd性video | 亚洲伊人成无码综合网 | 一本大道久久久久精品嫩草 | 国产ts丝袜人妖系列视频 | 国产精品自产拍高潮在线观看 | 欧美日韩一二 | 日本高清视频一区 | 一区亚洲| 成人免费一区二区 | 国语播放老妇呻吟对白 | 蘑菇视频hd在线 | 欧美顶级metart裸体全部自慰 | 波多野结衣乳巨码无在线观看 | 女生叉开腿让男生捅 | 欧美36p | 香蕉福利视频 | 色在线综合 | 脱内衣裸身吻胸床戏 | 日韩高清精品免费观看 | 性爱免费视频 | 久久久精品人妻无码专区 | 欧美一级一区 | 亚洲成人精品视频在线观看 | 成人在线精品视频 | 国产又黄又粗又猛又爽 | sleepless动漫在线观看免费播放 精品视频三区 | 欧美无砖砖区免费 | 国产精品va无码一区二区三区 | 色内内电影网 | 欧美作爱视频 | 电影院被陌生人摸揉双乳h 日韩av综合网站 | 国产精品三级在线观看 | 欧美特级黄 | 圣女被打开双腿触手调教视频 | 污片免费在线观看 | 国产精品午夜福利 | 日韩午夜剧场 | 蓝猫淘气三千问恐龙时代 | 国产又黄又粗又爽 | 一级性生活大片 | 亚洲999 | 国产深夜福利 | 性少妇freesexvideos高清 | 操丝袜少妇 | 色欲欲www成人网站 韩国三级电影播放 | 国产精品爽 | 国产办公室系列 | 亚洲精品久久久久中文第一幕 | 亚洲经典一区二区 | 国产欧美日韩综合 | 天天干狠狠爱 | 日本护士毛茸茸体内精 | 性欧美xxxx | 亚洲国产视频一区 | 日韩欧美福利视频 | 国产黄片一区二区三区 | 日韩精品无 | 黄色性生活一级片 | 美女黄色小视频 | 日韩欧美精品 | 特级黄色录像 | 一区二区不卡在线 | 国产一区二区精品丝袜 | 国产在线一区二区 | 欧美三级不卡 | 粉嫩av网| 亚洲h在线观看 | 日本韩国在线观看 | 久久激情综合 | 亚洲综合伊人 | 天天拍夜夜操 | 337p粉嫩大胆噜噜噜亚瑟影院 | 日韩精美视频 | 国产视频二区 | 无码视频在线观看 | 久久久天堂国产精品女人 | 黄色污污视频 | 国产小u女发育末成年 | 亚洲精品乱码久久久久久久久久久久 | 国产一区二区三区视频在线播放 | 老司机免费在线视频 | 天天狠天天操 | 啪啪福利视频 | 男生和女生一起差差差视频 | 国产在线第一页 | 99午夜 | 国产精品久久久久久久成人午夜 | 高清国产一区 | 国产一卡二卡三卡 | 日本裸体女优 | 91手机在线视频 | 日韩午夜在线观看 | 日韩欧美中文 | 精品久久久久中文慕人妻 | 亚洲色图小说 | 亚洲国产视频一区 | 色片视频 | 欧美黄片一区二区三区 | 欧美日韩一区二区三区在线 | 在线看黄网 | 日韩国产综合 | 少妇在线观看 | 一级真人毛片 | 视频丨9l丨白浆 | 国产精品国产精品 | 一级黄色免费网站 | 黄色大片免费观看 | 亚洲综合小说 | 国产精品2018 | 又色又爽又黄gif动态图 | 国产成人在线免费 | 日韩欧美国产高清 | 双性皇帝高h喷汁呻吟 | 他揉捏她两乳不停呻吟视频 | 欧美另类v | 欧美大片免费看 | 国产av无码专区亚洲av毛片搜 | 久草毛片 | 日韩欧美亚洲一区二区三区 | 制服丝袜天堂 | 四虎影视在线 | 亚洲成年人专区 | mm131丰满少妇人体欣赏图 | 国产女处被破www免费 | 欧美在线视频免费播放 | 久久视频在线免费观看 | 欧美卡一卡二 | 国产午夜免费视频 | 色片在线播放 | 久久久久无码精品国产 | 欧美视频免费在线观看 | 我想看毛片 | 99re视频在线观看 | 成人免费无遮挡无码黄漫视频 | 91在线观看高清 | 91免费视频播放 | 热99精品| 口述我的初苞被强开 | 亚洲免费视频网站 | 萌白酱福利视频 | 欧美视频免费在线观看 | 性感少妇av | 欧美色图在线播放 | 亚洲视频中文字幕 | 91国产丝袜播放在线 | 激情小说在线 | 亚洲国产剧情 | 欧美在线中文 | 九九天堂 | 视频一区日韩 | 国产在线中文字幕 | 日剧电影大尺度免费完整版 | 成人情趣视频 | 裸体女人免费视频 | 乱色精品无码一区二区国产盗 | 3级毛片| 69亚洲| 久久久精品人妻无码专区 | 风间由美在线视频 | 亚洲视频网站在线观看 | 黄色污污视频在线观看 | 女女百合调教丨vk | 久久精品7 | 精品福利在线观看 | 日本一区二区精品视频 | 伊人久久久久久久久 | 免费激情视频网站 | 欲奴性猛交3未删减 | 91在线观看免费 | 激情文学88 | 国产精品mv | 蜜桃视频网 | 中国xxxxxxxxx | 美女一区二区视频 | 69婷婷国产精品入口 | 在线观看麻豆视频 | 国产精品自拍一区 | 91老师片黄在线观看 | 毛片女人 | 吊侵犯の奶水授乳羞羞漫画 | 成人av一区二区三区在线观看 | 午夜精品三级久久久有码 | 在线观看中文字幕码 | 日韩国产片| 曰韩av| 麻豆蜜桃91 | 日韩一级一区 | 短裙公车被强好爽h吃奶视频 | 交换配乱淫东北大坑性事视频 | 亚洲av中文无码乱人伦在线视色 | 公和我乱做好爽添厨房中文字幕 | 少妇一级淫片免费放播放 | 日韩中文字幕一区二区三区 | 日韩欧美一区在线 | 国产1页| 91色在线观看 | 波多野结衣日韩 | 欧美大片高清免费观看 | 吸咬奶头狂揉60分钟视频 | 骚黄网站 | 美女变态网站 | 三级性生活片 | 亚洲色图国产精品 | 少妇精品视频 | 日本寂寞少妇 | 亚色图| 丰满人妻综合一区二区三区 | 少妇裸体视频 | 欧美a在线观看 | www.com捏胸挤出奶 | 久久国产露脸精品国产 | 女生叉开腿让男生捅 | av在线收看 | 大尺度舌吻呻吟声 | 亚洲激情一区 | 久久久999精品 | 猛男gaygay免费网站漫画 | 91免费片| 免费在线观看的av | 欧美天天影院 | 中国黄色一级片 | 吸咬奶头狂揉60分钟视频 | 天堂在线中文 | 小受受扒开屁股挨网站 | 亚洲永久av| 日日干夜夜操 | 亚洲a毛片 | 国产精品178页 | 亚洲一区二区色 | 午夜影院免费试看 | 亚洲熟妇色自偷自拍另类 | 999久久精品 | g点强制高潮惩罚 | 毛片av免费看 | 麻豆入口 | 在线91 | 一卡二卡三卡四卡五卡 | 久久精品视频99 | 这里只有精彩视频 | 好吊色视频988gao在线观看 | 亚洲色女 | 综合另类| 国产精品人成在线观看免费 | 黄色一级片网站 | 特级黄色大片 | 毛片视频在线免费观看 | 操操影视 | 超碰69 | 日韩午夜在线观看 | 荔枝视频污 | 九色自拍视频 | 99久久婷婷 | 丁香花五月天 | 欧美激情办公室 | 男的艹女的视频 | 天天影视综合 | 五月情网| 韩国深夜啪啪综艺无删减 | 国产做a爰片aaaaaoooo | 欧美成人aaa片一区国产精品 | 日韩一区二区精品 | 97国产精品视频人人做人人爱 | 伊人影院在线观看 | 成人av手机在线观看 | 欧美黑人添添高潮a片www | 色综合久久网 | 亚洲欧美激情视频 | 日日操夜夜撸 | 国产精品果冻传媒 | 欧美日b视频 | 亚洲精品久久久久中文字幕二区 | 久久国内视频 | 一本一道人人妻人人妻αv 男人日女人b视频 | 成人亚洲一区 | 啊灬快c我灬啊灬用力灬啊灬 | 日韩不卡在线观看 | 国产无套精品一区二区 | 欧美日韩第一区 | 免费美女视频 | 韩国激情呻吟揉捏胸视频 | 欧美另类极品videosbest使用方法 | 色黄网站在线观看 | 狠狠地日 | 成人一区二区三区在线 | 大黑人巨大荫蒂大交女人 | 男女无遮挡免费视频 | 萌白酱福利视频 | 国产性生活 | 嗯~啊~快点死我小说 | 爱情岛论坛永久入址测速 | 日韩一级在线 | 国产视频一二区 | 久久精品在线 | 青青草原国产 | 福利视频在线导航 | 伊人夜夜躁av伊人久久 | 可以免费看av| 日本一区二区精品视频 | 成人久久久精品乱码一区二区三区 | 插插插插插插插插插插 | 乳色吐息在线观看 | 欧美激情办公室 | 日本精品一区 | 精品久久久久久久 | 亚洲啊v在线观看 | 成人av电影网站 | 国内自拍偷拍视频 | 美女国产在线 | 日本不卡视频在线 | 久久黄色录像 | h在线免费 | 五月婷婷六月色 | av网址在线免费观看 | 国产精品白虎 | 3级黄色片 | 伦理片一区二区 | 宝贝乖h调教灌尿穿环 | 欧美国产一级片 | 看看毛片 | 亚洲a视频 | 内射合集对白在线 | 中文字幕观看在线 | 日韩一区精品 | 亚洲综合伊人 | 亚洲区在线| 日本夫妻性生活视频 | 日韩免费三级 | 少妇在线观看 | 日韩爱爱网| 欧美色偷偷 | 欧美高清在线观看 | 亚洲综合图片网 | 欧美最猛性xxxxx(亚洲精品) | 少妇熟女高潮流白浆 | 97国产精品久久 | 性生交大全免费看 | 超碰97av| 97人人射 | 色综合激情 | 曰本黄色大片 | 谁有那种在线观看的电影 | 17c在线观看视频 | 午夜欧美视频 | 高清国产一区 | 欧美日韩一二区 | 欧美人与性动交g欧美精器 国产91在线播放精品91 | 午夜伦伦| 插插插插插插插插插插 | 丁香婷婷网 | 二个少妇帮我囗交 | 婷婷啪啪 | 在线v片| 国产情侣小视频 | 欧美丰满老熟妇xxxxx性 | av一区在线 | 激情一区| 色婷婷久久综合 | 亚洲熟妇无码av | 日韩欧美日本 | 性日本xxx | 国产又粗又猛又黄视频 | 亚洲国产网站 | 男女视频在线观看免费 | 国产精品成人免费看片 | 扒开双腿猛烈地灌满精子男男 | www.好了av| 欧洲久久久久 | 欧美性猛交7777777 | 在线你懂的 | 无码人妻丰满熟妇精品 | 亚洲欧洲三级 | 熟女毛毛多熟妇人妻aⅴ在线毛片 | 亚洲精品一区二区三区四区高清 | 日韩第九页 | 亚洲成年网站 | 日韩成人免费观看 | 亚洲欧洲另类 | 亚洲最大中文字幕 | 91手机在线视频 | 国产精品8 | 视频一区国产精品 | 国产三级三级在线观看 | 成人在线观看网站 | 亚洲爱爱视频 | 精品久久久av | 日本做爰全过程免费看 | www日本视频 | 青青草视频| 亚洲精品一区二区三区四区高清 | 日本三级视频在线观看 | 日本三级大乳吃奶 | 99热欧美| 男叉女视频| 男女啪啪动图 | 亚洲77777| 操欧美大逼 | 久久免费视频1 | 漂亮的岳hd中文字幕 | 久久久一 | 视色视频 | 欧美三级电影在线 | 182tv线路一 成年视频在线观看 | 中文字幕电影 | 久草视频免费在线播放 | 亚洲欧洲日韩综合 | 精品日韩欧美 | 人蛇交高h太爽了h | 色撸撸在线视频 | 成人免费看片在线观看 | 久久最新网址 | 大奶子影院 | 黄频在线观看 | 国产一区免费视频 | 五月婷婷六月激情 | www.五月激情 | 美艳尤物h双性受1v1 | 久久午夜夜伦鲁鲁一区二区 | 日韩成人午夜电影 | 我把护士日出水了视频90分钟 | 日韩在线色 | 国产视频一二区 | 《给我播放》免费观看 | 日本在线小视频 | 亚洲毛片久久 | 一男一女操 | 四色永久访问网站 | 天堂av影院 | 国产精品资源在线观看 | 亚洲综合伊人 | 精品久久久精品 | 亚洲成人高清在线 | 国产精品扒开腿做爽爽爽男男 | 国产日韩精品入口 | 成人国产一区二区 | 天天艹夜夜艹 | 日本在线精品视频 | 久久精品视频1 | 成人黄色av网站 | 九九精品九九 | 人人av在线 | 殴美性生活 | 色撸撸av| 调教在线观看 | 国产夫妻性爱视频 | 成人av电影网站 | 成人午夜大片 | 色婷五月天 | 亚洲一二三区在线观看 | 女s打女m屁股|vk | 黄色网页在线观看 | 四虎4hu| 国产一区二区三区四区视频 | 日韩成人午夜电影 | 中文字幕啪啪 | 日本公妇乱偷中文字幕 | 日韩欧美一卡 | 神秘电影永久入口 | av福利网站 | 视频一区欧美 | 日韩免费中文字幕 | 沈悦高志欣 沈镇南原著小说 | 黄色片在线看 | 日韩成人午夜电影 | 一男一女在床上拔萝卜 | 久久精品国产亚洲AV无码男同 | 久草资源站 | 女仆淫院 | 日本加勒比在线 | 男操女的逼 | 中国白嫩丰满人妻videos | 久久精品国产亚洲AV无码男同 | 台湾三级台湾三级dvd影视 | 欧美午夜精品久久久久久人妖 | 天天爱夜夜做 | 国产福利91精品 | 玖玖在线 | 久久久精品网 | 性感美女在线 | 国产一区二区三区四区在线观看 | 日本在线精品视频 | 精品黑人| 在线观看视频一区二区三区 | 亚洲欧洲另类 | 日韩欧美福利视频 | 91久久色 | 17c在线观看视频 | av在线毛片 | 国产三级福利 | 日韩经典av | 欧美在线不卡 | 窝窝午夜精品一区二区 | 91五月天| 99热在线播放 | 欧美理伦 | 韩国美女视频在线观看18 | 18视频在线观看男男 | 女人下边被添全过视频 | 成人在线观看网站 | 精品人伦一区二区三区 | 中文字幕理伦片免费看 | 在线观看高清视频 | 娇小6一8小毛片 | 快播视频在线观看 | 九草在线视频 | 中文字幕无码乱码人妻日韩精品 | 18视频在线观看男男 | 成人午夜电影在线观看 | 亚洲小视频在线观看 | 人妻熟女一区二区三区 | 性爱视频免费 | 一边摸内裤一边吻胸 | 性欧美1819性猛交 | 黄色激情视频网站 | 男女作爱免费网站 | 极品女神无套呻吟啪啪 | 高潮失禁喷水颤抖哭叫视频 | 成年人网站在线 | 国产精品高清网站 | 国产午夜三级一区二区三 | 色婷婷激情av | 国产男同gay男男麻豆 | 国产精品久久久久久久成人午夜 | 日本在线视频中文字幕 | 日韩欧美91 | 羞耻调教憋尿(高h,1v1) | 久久精品高清 | 爱爱网视频 | 国产精品91av | 免费啪啪小视频 | 国产片在线播放 | 美女尿尿视频 | 国产乱码77777777| 免费观看日批视频 | 女人高潮叫床骚话污话 | 波多野结衣av在线观看 | 999精品视频在线观看 | 婷婷看片| 被夫上司蹂躏的七天七夜在线观看 | 成年女人毛片 | 国产精品美女在线观看 | 欧洲天堂网| 91九色视频在线 | 国产h在线| 亚洲videos| 欧美视频一区二区三区四区 | 国产电影av | 性欧美另类 | 丝袜脚交国产在线观看 | 亚洲女优视频 | 午夜视频免费 | 浪漫樱花动漫在线观看免费 | 91麻豆精品国产91久久久久久久久 | av狠狠干| 人人插人人射 | 中文字幕一二区 | 国产第五页 | 欧美日韩少妇 | 美利坚合众国av | 九九精品视频在线观看 | 婷婷九月| 蜜桃成人免费视频 | 中国一级黄 | 伦理片一区二区 | 天天躁夜夜躁狠狠躁av | frxxeexxx麻豆hd | 亚洲性xxxx| 外国av| 日本公妇乱偷中文字幕 | 精品国产乱码一区二区三区 | 久久裸体| 色呦呦国产 | 图片区小说区视频区 | 脱了内裤互相蹭很舒服 | 欧美做受69 | 久久99久久99精品蜜柚传媒 | 亚洲蜜桃精久久久久久久久久久久 | 四虎免费看黄 | 国产二区视频在线观看 | 九色91 | 3d动漫精品h区xxxxx区 | 少妇在线观看 | 涩涩网址 | 日韩午夜在线观看 | 国产欧美二区 | 日本免费黄色电影 | 色人阁av| 亚洲首页| 日韩伦理中文字幕 | 老牛嫩草二区三区观影体验 | 午夜视频免费 | 91麻豆精品国产91久久久更新资源速度超快 | 亚洲av成人无码网天堂 | 亚洲精品一区二区三 | 国色天香av | 曰批女人视频在线观看 | 午夜视频黄 | 调教小屁屁白丝丨vk | 午夜性色福利视频 | 91色站| 在线播放日韩 | 热99精品| 九月丁香婷婷 | 久久久精品蜜桃 | 亚洲国产欧美另类 | 日韩a级片| 人妻大战黑人白浆狂泄 | 成人在线精品视频 | 伊人国产在线 | 波多野结衣高清在线 | 艳妇乳肉豪妇荡videos | 久久超 | 日批视频 | 亚洲图片欧美在线 | 日韩每日更新 | 国产又大又黄又爽 | 亚洲日批 | 国产一区二区三区在线视频 | 性色在线观看 | 你懂的国产在线 | 男女网站视频 | 亚洲h片 | 国产精品ww | 韩国深夜啪啪综艺无删减 | 日日干日日射 | 欧美一级鲁丝片 | xxx日本黄色| 日本在线网址 | 免费一区二区在线观看 | 国产小视频免费在线观看 | 裸体女人a级一片 | 色男av| 在线国产一区二区 | 成人欧美精品一区二区 | 日韩免费看 | www.久久综合| 日韩欧美一区二区三区在线观看 | 神马久久午夜 | 好吊妞这里有精品 | 草草视频在线观看 | 猛男gaygay免费网站漫画 | 国产黄色播放 | 亚洲成人av一区二区三区 | 中文字幕二区三区 | 男操女在线观看 | 日韩国产综合 | 男人免费网站 | 4虎影音| 女口述最爽的性经历 | 少妇一边喂奶一边我做 | 性教育av | 亚洲xxxxxx| 欧美性猛交7777777 | 久操国产视频 | 国产视频一区在线观看 | 一本到| 97自拍| 午夜精品久久久久久久 | 爽天天天天天天天 | 口述被爽到呻吟高潮自述 | 制服.丝袜.亚洲.中文.综合懂 | 久久精品在线免费观看 | 狂野欧美性猛交xxxx | 午夜伦情 | 亚洲色图第三页 | 欧美极品少妇xxxxⅹ喷水 | 亚洲人毛茸茸 | 欧美另类高清 | 国产午夜精品久久久 | 久久久久久看片 | 一边摸内裤一边吻胸 | 色婷婷亚洲精品 | 亚洲喷水| 国产精品v亚洲精品v日韩精品 | 人妻丰满熟妇av无码久久洗澡 | 国产精品mv | 68日本xxxxxⅹxxx22 | 亚洲精品久久久久avwww潮水 | 久久伊人五月天 | 91五月天 | 奇米在线播放 | 国产精品一区二区三区在线播放 | 国产毛毛片 | 天天精品视频 | 亚洲欧美国产毛片在线 | 国产成人片 | 爱豆国产剧免费观看大全剧集 | 怡红院av在线播放 | 国模一二三区 | 闺蜜性事交换5 | 久久精品一区二区三区四区 | 欧美一区日韩一区 | 夫妇交换性经过 | 另类少妇人与禽zozz0性伦 | 亚洲va在线观看 | 日韩一区二区三免费高清在线观看 | 手机在线看片 | 性色tv| 亚洲a在线观看 | 99精品在线 | 亚洲成人av在线电影 | 国产做受高潮动漫 | 在线天堂中文在线资源网 | 久久精品国产99 | 妹妹av| 五十路av| 视频丨9l丨白浆 | 国产专区一 | 欧美顶级metart裸体全部自慰 | 特级西西人体wwwww | 亚洲欧美日韩色图 | 国产精品一区二区三区在线 | 韩国理伦大片 | 性狂虐xxxxx变态胶衣胶奴视频 | 国产午夜在线视频 | 潘金莲一级淫片 | 黑丝av在线 | 男人肌肌桶女人肌肌 | 亚洲精品黄色 | 欧美一级特黄视频 | 欧美日本另类 | av网站在线免费观看 | 非洲黑人毛片 | 久操国产视频 | 男女91视频| 台湾三级台湾三级dvd影视 | 深夜福利视频导航 | 亚洲美女久久久 | 色撸撸在线视频 | 男人日女人b视频 | 日本久久精品视频 | 两根一起进蹂躏3p | 天天拍夜夜操 | 丝袜脚交视频 | 日本久久久久久久久久 | 性视频网| 久久综合av| 精品一区二区三区在线视频 | 色综久久| 屁屁浮力影院 | 色黄网站在线观看 | 国产精品无码午夜福利 | 亚洲九九 | 浪漫樱花动漫在线观看免费 | 国产一区二区视频免费 | 午夜生活片 | 欧美理伦少妇2做爰 | 国产精品91视频 | 人妻精品久久久久中文字幕69 | 国产又爽又黄免费视频 | 青青草一区| 操欧美大逼 | 日本加勒比在线 | 精品久久国产 | 成人免费网站视频 | 六月丁香婷婷综合 | 99中文字幕在线观看 | 谁有那种在线观看的电影 | 少妇又紧又色又爽又刺激视频 | 激情小说激情视频 | 日韩免费精品 | 中文字幕观看视频 | 波多野结衣在线一区二区 | 久久一区| 电影一区二区三区 | 啊用力嗯轻一点h | 亚洲一二三四 | 日本高清视频www | 污片免费在线观看 | 超碰最新网址 | 超碰av网 | 亚洲免费影院 | 日本a级在线 | 亚洲天堂手机版 | www.av在线视频 | 国产精品a久久久久 | 久久久久国产精品人妻aⅴ院 | 放荡青春 | av一区二区三 | 诱惑の诱惑筱田优在线播放 | 国产精品电影一区二区 | 国产黑人 | 最新av女优| 亚洲另类视频 | 日韩中文字幕在线看 | av在线不卡电影 | 欧美xxx在线观看 | 五月精品| 丰满人妻熟女aⅴ一区 | 在线综合+亚洲+欧美中文字幕 | 综合久久精品 | 乱淫视频 | 欧美一二三区视频 | 中文字幕精品一二三四五六七八 | 国产成人精品自拍 | 日本精品视频一区 | 玩偶姐姐在线看 | 丰满的妻子 | 另类一区二区三区 | 欧美日韩一区二区三区在线 | 亚洲精品一区二区三区在线 | 日韩在线不卡 | 国产精品久久久久久无人区 | 成人福利网址 | 国产传媒视频在线观看 | 韩国三级黄色 | 久久免费视频网 | 午夜精品久久久久久久99热浪潮 | 嘿咻免费视频 | 男女吻胸做爰摸下身 | 扒开双腿让70岁老头看 | 美女啪啪免费视频 | 大尺度av | 91成人app| 黄色性生活一级片 | 裸体女人免费视频 | 亚洲一区在线观看视频 | 日韩免费视频观看 | gogogo日本免费观看电视剧最 | 黄色片大全 | 男人舔女人逼视频 | 久久黄网站 | 爱爱15p | 国产乱淫av片免费 | 青青草免费在线 | 日韩天堂av| 天天拍夜夜操 | 亚洲精品成人在线视频 | 男人舔女人逼视频 | 午夜福利视频 | 国产精选第一页 | 亚洲一区二区三区中文字幕 | 成人日韩精品 | av在线手机观看 | 精品黑人一区二区三区 | 啊灬快c我灬啊灬用力灬啊灬 | 中文字幕精品一二三四五六七八 | 国产永久精品大片wwwapp | 老师露出强行让男生揉动漫 | 侏儒人被黑人蹂躏mp4 | 99视频网站 | 久久久精品影视 | 日本高清不卡视频 | 狠狠cao日日穞夜夜穞av | 亚洲色图欧美另类 | 亚洲精品乱码久久久久久 | 娇小激情hdxxxx学生 | 国产一级免费视频 | 欧美日韩一区二区三区在线 | 在线a天堂 | 国产精品日韩精品 | 国产精品揄拍一区二区 | 日韩免费观看 | 亚洲色图导航 | 久久久精品网 | 好吊妞这里有精品 | free性丰满hd性欧美4k | 午夜视频黄 | 成人精品二区 | 日本性爱视频在线观看 | 浮力影院国产第一页 | 久久裸体视频 | 免费性片 | 玩偶姐姐在线观看免费 | 中文字幕av第一页 | 三级视频在线观看 | 午夜伦情 | 香蕉视频免费在线观看 | 人妻一区在线 | 大黑人巨大荫蒂大交女人 | 国产精品电影一区二区 | 精品国产乱码久久久久久蜜柚 | 沈悦高志欣 沈镇南原著小说 | 国产大尺度视频在线观看 | 久久最新网址 | 久久福利电影 | 久久老女人 | 日韩成人免费观看 | 免费黄色看片网站 | 性欧美视频在线观看 | 黄色小说视频在线观看 | 欧美疯狂做受xxxxx高潮 | 国产草草影院ccyycom | 97在线观看视频 | 天天操天天干天天操 | 免费成人深夜 | 五月婷婷色| 中文字幕二 | 国产精品久久九九 | 国产丝袜av | 闺蜜调教绿帽龟奴重口 | 成人免费看片在线观看 | 日本三级免费看 | 少妇人妻精品一区二区三区 | 污片免费在线观看 | 亚洲三级网 | 小宵虎南在线观看 | 中文字幕成人在线 | 男女午夜激情 | 99资源| av毛片在线| 性视频网 | 老熟妇精品一区二区三区 | 福利精品| 少妇二级淫片免费天气预报 | 日韩欧美三级 | 黄色在线小视频 | 国产一区二区三区在线视频 | 色五丁香| 在线成人亚洲 | 国产三级三级在线观看 | 嫩草嫩草嫩草嫩草嫩草嫩草 | 中国女人特级毛片 | 少妇免费直播 | 国产丝袜av| 小鲜肉自慰网站 | 色噜噜狠狠一区二区三区果冻 | 国产精品久久久久久久妇 | 久久午夜夜伦鲁鲁一区二区 | 久久大胆 | 久久亚洲精品小早川怜子 | 色婷五月天 | 男人天堂网av | 亚洲免费一区二区 | 亚洲成人av一区二区三区 | www.免费av| 欧美激情久久久 | 肉大捧一进一出免费视频 | 日韩在线精品视频 | 国产一区免费视频 | 成年视频在线观看 | 亚洲精品一区二区三区区别 | 欧美激情办公室 | 久久偷看各类女兵18女厕嘘嘘 | 日韩精品极品 | av软件在线观看 | 精品久久久av | 触手动漫 | 国产午夜一级一片免费播放 | 国产成人91 | 色伊人av | 成人麻豆视频 | 永久免费无码av网站在线观看 | 亚洲欧美另类在线视频 | 做爰全过程叫床视频 | 久久机热 | 欧美日韩电影一区 | 人人av在线 | 大尺度舌吻呻吟声 | 免费黄色日本网站 | 成人一区二区三区在线 | 日韩视频在线观看免费 | 国产中文在线观看 | 国产一区二区成人 | 被粗暴强迫侵犯在线观看 | 欧美日韩一二三四 | 欧美在线一级片 | 成人性电影 | 美女aaa| 男人天堂网av | 亚洲精品www| 久久另类ts人妖一区二区 | 欧美性视频网站 | 亚洲久草 | 曰批女人视频在线观看 | 人人舔人人 | 一级片在线观看免费 | 自拍视频网 | 女人裸体又黄 | 男生操女生免费网站 | 邻家有女4完整版电影观看 欧美性fee | 中国女人内射6xxxxx | 亚洲天堂资源 | 欧美日韩在线视频一区 | 欧美一级鲁丝片 | 欧美国产三级 | 不卡在线 | 一区二区三区免费在线观看 | 污污在线 | 偷拍精品一区二区三区 | 日韩精品www| 成人一区二区三区在线 | 精品久久久久久久久久久 | 91在线精品李宗瑞 | 色男天堂| 亚洲精品福利 | 国产小视频在线看 | 小宵虎南在线观看 | 色国产在线 | 99久久久国产 | 色男av| 久久久久伊人 | 国产一级一片免费播放 | 天天操天天摸天天干 | 兄弟兄弟全集免费观看 | 成人自拍视频 | 羞辱狗奴的句子有哪些 | 被夫上司蹂躏的七天七夜在线观看 | 国产专区一 | 精品国产aⅴ一区二区三区东京热 | 麻豆传媒在线观看 | 青娱乐国产 | 亚洲美女视频 | 久色婷婷| 在线看成人 | 国产在线一二三 | 色就色欧美 | 日韩激情网址 | 看看毛片 | 国产免费大片 | 娇妻张妍交换高潮 | 久久久久久黄色 | 免费电影av | 黄色片子视频 | 丰满大乳露双乳呻吟 | 日本五十路在线观看 | 91亚洲国产精品 | 蓝猫淘气三千问恐龙时代 | 夜夜夜影院 | 久久视频一区二区 | 国产三级午夜理伦三级 | av美女在线观看 | 欧美三级午夜理伦 | aaa亚洲| 欧美在线观看一区二区 | 成人免费看片视频 | 人人妻人人澡人人爽精品日本 | 波多野结衣三级 | 91免费视频播放 | 全是肉的高h文〈男男〉 | 国产伦精品一区二区三区 | 三级黄色短视频 | 国产精品熟女一区二区不卡 | 91色综合 | 一区二区在线免费视频 | 黄色三级视频 | 国产成人高清 | 日韩一区二区视频在线 | 欧美福利视频 | 日本三级网 | 精品国产麻豆 | 国产全肉乱妇杂乱 | 手机在线看片 | 情趣调教喷水h | 大香焦伊人 | 国产一区二区在线视频 | 娇妻被朋友强得嗷嗷叫 | 久久久精品福利 | 久久最新网址 | 激情五月色播五月 | 91成年视频| 二个少妇帮我囗交 | 日韩一区二区视频在线 | 羞羞漫画在线登录页面免费漫画入口页面cnmo | 一级理论片 | 亚洲熟女乱色综合亚洲小说 | 欧美理论片在线观看 | 羞耻调教憋尿(高h,1v1) | 日本免费黄色电影 | av青青草| 韩国激情呻吟揉捏胸视频 | 微拍福利一区二区 | 久久老女人 | 亚洲永久av | 亚洲国产精品免费 | 国产无人区码熟妇毛片多 | 亚洲综合婷婷 | 少妇高潮露脸国语对白 | 日本在线免费视频 | 一级黄色免费网站 | 污的网站| 亚洲成人毛片 | 国内毛片毛片毛片 | 少妇xxx| 免费观看国产视频 | 久章草影院 | 中文字幕一二区 | 清宫性史3| 日本熟妇一区二区三区 | 淫僧荡尼巨乳(h)小说 | 她享受粗啪滋嗯大爷轻点视频 | 国产精品扒开腿做爽爽爽男男 | 欧美大片黄 | 国产又黄又粗又爽 | 日韩一区二区视频在线 | 亚洲黄色免费 | 成人av在线网 | 性黄色小说 | 国产福利电影在线观看 | 波多野结衣在线播放 | 男女超碰 | 人人澡人人干 | 在线观看免费视频a | 一二三四在线视频 | 另类一区二区三区 | 91精品国产综合久久久蜜臀 | 亚洲一区在线播放 | 超级碰碰视频 | 福利视频网站 | www.伊人| 黄a在线| 亚日韩在线 | 天天爱天天射 | 荔枝视频污 | 国产又爽又黄免费视频 | japanese在线观看 | 久操香蕉| 国内自拍偷拍 | 一本到在线 | 国产精品无码在线播放 | 久草综合在线视频 | 一本大道在线 | 小辣椒福利视频导航 | 视频一区在线观看 | 99视频免费在线观看 | 亚洲欧美日韩在线播放 | 中文字幕电影av | 男人和女人日b视频 | 白丝女仆被免费网站 | 色一情一乱一伦一区二区三区 | 丝袜美女被羞羞网站 | av毛片在线播放 | 三级黄色av | 视频一区国产精品 | 久久久天堂| 国产传媒视频在线观看 | 国产精品一区二区三 | 一本一道人人妻人人妻αv 男人日女人b视频 | 久久久久久久久久一区二区三区 | 日少妇小说 | 国产精品久久久久久一区二区三区 | 高h喷水荡肉爽文1v1沉芙 | 久久久免费av | 日一日操一操 | 女人下边被添全过视频 | 日韩精品一区二区三区四区五区 | 大学生毛片 | 日韩精品一区二区三区高清免费 | 国产不卡免费视频 | 日本护士ⅹ动态图 | 日韩成人免费在线视频 | 91久久电影 | 亚色中文 | 国产精品无码午夜福利 | 大桥未久中文字幕 | 亚洲一区小说 | 黄页网站在线观看 | 51调教丨国产调教视频 | 成人高清视频在线观看 | 美女久久| 91精品久久久久久久99蜜桃 | 国产精品88 | 中文字幕巨乳 | 欧美色图自拍 | 亚色成人 | 三年免费高清大全电影 | 免费看a级片 | 黄色国产视频 | 波多野结衣av在线免费观看 | 中文字幕在线观看线人 | 激情九月天 | 九九精品视频在线观看 | 欧美资源在线 | 日韩午夜在线观看 | 国产激情影院 | 名校风暴在线观看免费高清完整 | 圣女被打开双腿触手调教视频 | 日本熟妇一区二区三区 | 国产三级三级在线观看 | 国产精品久久久久久久久久久久久久久久久久 | 林由奈在线观看 | www.国产免费 | 最近更新中文字幕 | 日本高清不卡一区 | 男男play呻吟动漫网站 | 伦理片av | 黄色一级免费看 | 脱了内裤互相蹭很舒服 | 久久久性视频 | 天天干狠狠爱 | 国产视频99 | 中文字幕3页 | 亚洲精品女人 | 看毛片的网址 | 熟妇人妻av无码一区二区三区 | 天天艹 | 天堂av2014| 97射射| 午夜国产视频 | 国产草草 | 孕妇激情视频 | 亚洲色图国产精品 | 一道本无吗一区 | 战狼3免费高清版 | 成人18视频在线观看 | 琪琪久久| 欧美色图在线播放 | 免费久久精品 | 中文字幕日日夜夜 | 国产精品久久av | 日韩在线观看第一页 | 日韩欧美国产精品 | 免费av一区二区三区 | 亚洲 欧美 日韩 在线 | 中国一级黄 | 欧美三级电影网址 | 欧美性一区二区三区 | 国产精品久久久久久久妇 | 午夜视频久久 | 天天激情 | 免费看一级片 | 人妻一区在线 | 男人把女人桶爽 | 日韩色av | 91狠狠干 | 欧美理论片在线观看 | avapp在线观看 | 97国产精品视频人人做人人爱 | 国产无人区码熟妇毛片多 | 日本一区二区三区在线免费观看 | 善良的公与媳hd中文字 | 漂亮的岳hd中文字幕 | 欧美日韩人妻精品一区二区三区 | 亚洲77777| 日韩综合一区 | 亚洲影视一区二区 | 日本做爰全过程免费看 | 北条麻妃一区二区三区 | 久久久www| 日韩专区欧美专区 | 成人精品在线播放 | 色婷婷成人网 | 黄色免费网站大全 | 91在线网站 | 亚洲成年人专区 | 啊啊啊快高潮了女视频 | 永久免费成人代码 | 爱的人电影全集免费观看 | 国产精品无码免费播放 | 国产男女网站 | 色男天堂 | 强行伸进她的小内裤疯狂揉摸视频 | 婷婷丁香一区二区三区 | 亚洲精品一区二区三区四区高清 | 偷拍夫妻性生活 | 亚洲色图第三页 | 91色片 | 国产区免费 | 亚洲天堂av电影 | 日本午夜精品理论片a级app发布 | 日本美女一区二区 | 色人阁视频 | 在线国产精品视频 | 亚洲成人第一页 | 中文字幕第四页 | 毛片直接看 | 色偷偷网站 | 久久午夜影视 | 欧美爽爽 | 美女叉开腿| 在线观看国产精品入口男同 | 亚洲爱视频 | 免费a网站| 女女同性高清片免费看 | 天天艹夜夜艹 | 麻豆回家视频区一区二 | 91在线观看高清 | 日本aaa视频| 91在线观看免费 | 少妇又紧又色又爽又刺激视频 | 欧美三级电影网址 | 国产精品欧美精品 | 99视频99| 男女啪啪免费网站 | 97在线视频免费观看 | 亚洲午夜精品久久久久久浪潮 | 人人插人人插 | 69亚洲| 日本高清不卡一区 | 久久精品国产99 | 天天爽天天做 | av青青| 晚上碰视频 | 亚洲国产精品免费 | 黄免费观看 | 欧美激情视频在线 | 成人h视频在线观看 | 18视频在线观看男男 | 一级片大全 | 最新女另类z000z000 | 国产专区一 | av片网址| 欧美黄色片 | 久久人人精品 | 99国产免费| 神马午夜888 | av电影日韩 | 免费观看一区二区三区 | 国产一区91精品张津瑜 | 日本视频免费观看 | 仓库糟蹋丰满少妇 | 久久激情片 | 波多野结衣av在线免费观看 | 高潮毛片又色又爽免费 | 亚洲综合小说 | av在线收看 | 久久久久无码精品国产 | 日韩中文字幕有码 | 噜噜色av| 欧美性生活xxx | 青青青青青草 | 麻豆成人在线视频 | 国产做受高潮动漫 | 欧美嫩交 | 91tv在线观看| 国产av无码专区亚洲av毛片搜 | 国产探花av | 免费看黄色av | 亚洲午夜免费视频 | 长腿校花呻呤迎合娇躯白嫩小视频 | 韩国av网| 日韩精品在线播放 | 国产极品久久久 | 欧美高清在线观看 | 阿v免费视频 | 国模一二三区 | 思思在线视频 | 同桌伸进内裤揉到高潮嗯啊 | 晚上碰视频| 免费黄色网络 | 海角社区深夜入口 | 一级做a爱| 国产真实乱子伦 | 亚洲国产成人综合 | 男女午夜激情 | 国内黄色片 | 贱奴张开腿给主人打烂 | 在线h网 | 男人j进入女人j内部免费网站 | 色老头综合网 | 亚色图 | 国产视频手机在线 | 进去里视频在线观看 | 亚欧在线观看 | 成人情趣视频 | 99久草 | 免费成人深夜 | 激情综合激情五月 | 在线观看免费视频a | 久久久久中文 | 永久免费无码av网站在线观看 | a级片黄色 | 欧美大片在线 | 成人动漫 | 国产伦精品一区二区三区免.费 | 日韩色区 | 久久一区| 欧美簧片在线 | 二个少妇帮我囗交 | 国产人与禽zoz0性伦 | 女攻总攻大胸奶汁(高h) | 久久新视频| japanese在线观看 | 啪啪福利视频 | 一边亲嘴一边做好爽视频 | 久久裸体 | 无码人妻精品一区二区三应用大全 | 椎名空在线| 他摸着我下面突然伸进去了视频 | 你懂得在线 | av黄色在线播放 | 91高清在线观看 | 国产日韩三级 | 日本久久精品视频 | 婷婷看片 | 国产ts丝袜人妖系列视频 | 国产绿帽一区二区三区 | 男同小说肉文 | 国产精品午夜电影 | 亚洲理论视频 | 国产情侣一区 | 欧美一级艳片视频免费观看 | 久久黄色大片 | 国产精品九九九九九 | 久久麻豆精品 | 亚洲另类av| 国产香蕉9 | 久久aⅴ无码av高潮av喷吹 | 天天操天天弄 | 高清18麻豆| 中文字幕啪啪 | 一级片a级片 | 美女网站免费 | 一区二区不卡在线 | 天天舔天天射天天干 | 日本一本在线 | 谁有免费黄色网址 | 亚洲尿pisssex撒尿 | 神马久久精品 | 俄罗斯videodesxo极品 | 你懂的国产在线 | 日韩精品免费一区二区 | 日韩色图在线观看 | 欧美毛片视频 | 国产中文在线播放 | 欧美国产精品一区 | 激情高潮呻吟抽搐喷水 | 人成在线视频 | 国产黄色在线观看 | 欧美中文字幕在线视频 | 俺去啦最新网址 | 国产三级伦理片 | 欧美日韩一二 | 精国产品一区二区三区a片 快色视频 | 欧美一及片 | 乱轮视频 | 欧美日本免费 | 胸大被男同桌强解开胸罩床吻 | 在线免费看av | av中文字幕在线看 | 日韩精品久久久久久 | 欧美三级 欧美一级 | 91喷水| www.激情.com | 亚洲黄色三级视频 | 成年人在线观看免费视频 | 国产高清不卡视频 | 911香蕉视频 | 粉嫩av网站 | 色男av| 91在线一区二区三区 | 中文日韩字幕 | 中国黄色三级 | 一起操在线观看 | 婷婷中文网| 国产女处被破www免费 | 成人免费激情视频 | 欧美特级黄色录像 | 久久久精品国产sm调教网站 | 超碰九七| 久久av一区二区三区漫画 | 嗯灬啊灬快灬高潮了 | 一区二区免费在线观看 | 日韩国产欧美视频 | 污在线看 | 自拍偷拍综合 | 少妇精品 | 性free公交车videos | 谁有免费黄色网址 | 最新中文字幕在线 | 黄色特级视频 | 秋霞午夜电影网 | 欲色天天| 爽妇网s| 玩偶姐姐在线观看免费 | 性福直播 | 国产九区 | 国产做受高潮动漫 | 一起射导航 | 日日干夜夜操 | 91正在播放 | 久久久精品国产sm调教网站 | 四虎4hu| 亚欧美日韩 | 91亚洲国产成人久久精品麻豆 | 日韩av高清在线观看 | 插插网站 | 成人拍拍拍 | 97激情| 亚洲jizzjizz日本少妇 | 欧美高h| 欧美性大交 | 亚洲精品国产精品乱码不99按摩 | 中文字幕无人区二 | 国产精品国产三级国产 | 日韩av电影一区 | 一级肉体全黄裸片中国 | 国产一区二区在线视频 | 国产一区免费在线观看 | 成人在线精品视频 | 日韩精品一区二区三区免费视频 | 亚洲福利一区二区 | 福利片国产 | 性吧av| 国产欧美一区二区 | 亚洲一区二区三区中文字幕 | 丨国产丨调教丨91丨 | 欧美亚洲激情 | 国产熟女高潮一区二区三区 | 特高潮videossexhd| 久久艳片www.17c.com | 日韩不卡在线观看 | www.日本黄| 欧美日韩在线观看视频 | 美国女孩毛片 | 免费日皮视频 | 男男涩涩小说 | japanese胖熊gaysextv| 九色91在线 | av片免费观看 | 特一级黄色片 | 亚洲va在线观看 | 国产一级电影 | 另类五月天 | 人人爽爽人人 | 激情自拍偷拍 | 图书馆的女友在线观看 | av资源库 | 羞耻调教憋尿(高h,1v1) | 成人av电影天堂 | 日韩精品久久久久久 | av免费不卡| 雪中悍刀行2大牛影库 | 二个少妇帮我囗交 | 色吧综合 | 先锋资源中文字幕 | 柔嫩的麻麻下面好紧 | 欧美黑人xxxx | 三级伦理片在线观看 | 免费毛片大全 | 天天爱天天爽 | 日韩中文字幕电影 | 91禁蘑菇在线看 | 国产精品国产三级国产 | 精品日韩欧美 | 国产午夜免费视频 | 女女百合调教丨vk | 99re国产精品视频 | 丰满人妻熟女aⅴ一区 | 成人久久精品人妻一区二区三区 | 美女黄色小视频 | 亚洲午夜影视 | 久久偷看各类女兵18女厕嘘嘘 | 免费观看黄色大片 | 殴美毛片 | 在线观看亚洲欧美 | h文在线观看 | 色欧美视频 | 人妻无码一区二区三区免费 | 日韩电影网站 | 国产又爽又黄免费视频 | 1024手机在线观看 | 日本人性爱视频 | 亚洲爱爱视频 | 诱惑の诱惑筱田优在线播放 | 色欲av永久无码精品无码蜜桃 | 国产日韩欧美视频 | 91人人爽 | 香蕉午夜 | 女s打女m屁股|vk | 色综合久久网 | 男人天堂2021 | 男女aa视频| 国产999在线观看 | 黄视频免费在线观看 | 久久视频99| 制服下的诱惑暮生 | 献给魔王伊伏洛基亚吧动漫在线观看 | 欧美极品一区二区 | 精品国产乱码久久久久久婷婷 | 97国产| 久久日av| 日本免费高清 | 久久久国| 中文字幕mv| 亚州av综合色区无码一区 | 台湾a级片 | 69视频免费| 九草在线视频 | 打屁股无遮挡网站 | 欧美日韩麻豆 | 欧美36p| 亚洲成人av一区二区三区 | 国产精品88 | 自拍偷自拍亚洲精品播放 | 中国xxxxxxxxx| 99午夜 | 国产99精品视频 | 天堂资源站 | 欧美大片高清免费观看 | 天天艹 | 这里只有精品9 | 毛片999| 制服.丝袜.亚洲.中文.综合懂 | 国产精品午夜影院 | 欧美黄色一区二区 | 免费看黄av| 亚洲一卡二卡在线 | 亚洲1234区 | 亚洲无码国产精品 | 看看毛片 | 欧美二区视频 | 丰满人妻熟女aⅴ一区 | 高清国产一区 | 六月婷婷网 | 精品久久久久久久 | 国产性生活| 色福利视频 | 成人一级黄色片 | 日本丰满熟妇videossex | 91成人免费在线观看 | 久久久久精 | 欧美性fee | 99视频免费在线观看 | 女口述最爽的性经历 | 成人三级在线播放 | 黄色网页在线观看 | 国产日韩视频 | 欧美一级特黄视频 | 久久99精品久久久久久琪琪 | 潘甜甜在线| 亚洲h在线观看 | 日韩在线视频不卡 | 久久久婷婷 | 日本免费黄色片 | 小珊的性放荡羞辱日记 | 成人交配视频 | 日本在线视频中文字幕 | 男人天堂网av | 婷婷激情综合网 | 免费看裸体网站 | 男男全程肉无删减电影 | 国产人妻精品一区二区三区不卡 | 一本色道久久综合亚洲精品酒店 | 久久久噜噜噜久久久 | 丁香啪啪 | 第四色成人网 | 91高清视频在线观看 | 国产成人精品在线 | 下一站婚姻全集免费观看 | 国产精品久久久久久无人区 | 无人在线免费观看视频 | 国产欧美a | 亚州色图欧美色图 | 欧美一区二区激情视频 | 天堂资源在线观看 | 乖…忍一下我就进一点视频 | 一本色道久久综合亚洲精品酒店 | 男男车车的车车网站w98免费 | 男女涩涩视频 | 综合激情五月婷婷 | 西西人体做爰大胆gogo | 欧美日韩麻豆 | 欧美色交| 日韩1页 | 久久99视频免费 | 九九精品国产 | 国产内谢 | 日韩三级电影网站 | 久久裸体视频 | 91九色视频在线 | 你懂的日韩| 天堂8中文 | 捆绑美女调教 | www五月天com| 日韩精美视频 | 五月婷久久| 午夜视频免费观看 | 午夜偷拍视频 | 日韩电影网站 | h文在线观看 | 精品播放| 久久超碰精品 | 最新av女优 | 五月开心网 | 综合激情在线 | 精品久久久av | 麻豆蜜桃91 | 一级黄色免费网站 | 91精品国产综合久久久蜜臀 | 国产精品xxxx | 成人精品在线播放 | 超碰在线播 | 全是肉的高h文〈男男〉 | 少妇精品偷拍高潮白浆 | 高跟鞋和丝袜猛烈xxxxxx | 久在线视频 | 视频区图片区小说区 | 丝袜天堂 | 视频区图片区小说区 | 久久久久久久久久国产 | 天堂av电影 | 中文久久乱码一区二区 | 午夜中文字幕 | 久久成人精品 | 成人免费无遮挡无码黄漫视频 | 黄色三级在线 | 亚洲无人区码一码二码三码的含义 | 亚洲成年人专区 | 午夜有码| 夫妇交换性经过 | 久久久一区二区三区四区 | 伊人网av | 成人精品在线播放 | 日韩三级久久 | 极品女教师裸体瑜伽视频 | 殴美毛片| 九九精品影院 | 日本欧美黄色 | 超碰夜夜 | 不卡影院| 白浆四溢| 成人av影视 | 无码国产精品高潮久久99 | 欧美视频一区二区 | 国产精品久久久久久久久久妞妞 | 97干视频| 久久与婷婷 | 亚洲激情久久 | 久久激情综合 | 日日干日日干 | 上司出差调教秘书hd | 国产日韩欧美视频 | 欧美乱操 | 91高清在线观看 | 国产伦理网站 | 91福利app| 国产熟女精品视频 | 日韩视频一二三 | 二级片网站 | 日韩免费看 | 丨国产丨调教丨91丨 | 日日干日日干 | 激情自拍偷拍 | 高h视频在线观看 | 日本免费福利视频 | 午夜高清 | 上司出差调教秘书hd | 色噜噜一区二区三区 | 久久天天躁狠狠躁夜夜爽蜜月 | 日韩精品999| 国产美女诱惑 | 国产一区二区在线视频 | 公交车被多人伦h | 91精品国产综合久久久蜜臀九色 | 三级视频在线观看 | 日本成人综合 | 一区二区三区精品视频 | 在线免费视频 | 天天狠天天操 | 日本黄色大片网站 | 丰满少妇乱子伦精品看片 | av网址在线免费观看 | 樱桃av| 痴汉电车在线观看 | 99性趣网 | 亚洲欧美日本另类 | 俺去啦最新网址 | 黑人干亚洲人 | 猛男gaygay在线观看 | 色视频导航 | 中国黄色一级大片 | 黄色激情视频网站 | 三级电影中文字幕 | 精品视频9999 | 爽天天天天天天天 | 黄色不卡 | 色噜噜狠狠一区二区三区果冻 | 夜夜爽夜夜 | 好看的国产精品 | 日本三级日本三级日本三级极 | 日韩社区| 亚洲无人区码一码二码三码的含义 | 欧美日韩中文字幕在线 | 神马久久精品 | 亚洲精品女人 | 俺去啦最新网址 | 美女啪啪免费视频 | 亚洲乱码视频 | 好爽快一点高潮了 | 在线高清观看免费观看 | 波多野结衣在线电影 | 黄色电影一级 | 久免费一级suv好看的国产 | 成人情趣视频 | av日韩精品| 精品视频久久久久 | 欧美特级黄色录像 | 精品欧美一区二区三区 | 日韩在线免费视频观看 | 91喷水| 午夜爱爱网 | 亚洲欧美综合在线观看 | av直接看| 免费美女视频 | 自拍偷拍亚洲 | 欧美人体做爰大胆视频 | 精品欧美一区二区三区 | 成人午夜又粗又硬又大 | 国产h视频在线观看 | 久久激情综合 | 日韩人妻无码一区二区三区 | 黄页网站免费观看 | av网址在线免费观看 | 最近更新中文字幕 | 国产一级精品视频 | 久久久精品网 | 免费看黄网站在线观看 | 久久久久久影视 | 深夜视频网站 | av在线综合网 | 国产一区在线视频 | 日本久久99 | 欧美激情久久久 | 波多野结衣在线一区二区 | 中文字幕日日夜夜 | 狠狠艹狠狠干 | 亚洲女优视频 | 午夜影院在线观看18 | 成人久久精品人妻一区二区三区 | 奇米影视在线播放 | 怡红院在线播放 | 国产精品一区二区三区在线播放 | 在线免费视频 | 国产免费一区二区三区在线观看 | 伊人夜夜躁av伊人久久 | 少妇69xx| 国产精品美女在线观看 | 强伦女教师2 | 丰满人妻熟女aⅴ一区 | 国产绿帽一区二区三区 | 性生活一级视频 | 伊人成综合网 | 制服丝袜天堂 | 日韩激情网 | 精品久久电影 | 亚洲国产一区二区波多野结衣 | 侏儒人被黑人蹂躏mp4 | 国产1页| 国产成人在线免费 | 九九久久精品视频 | 日韩一卡二卡 | 欧美bbbbbbbbbbbb18av | 伊伊成人 | 懂色av懂色av粉嫩av分享吧 | 欧美激情久久久 | 俄罗斯黄色大片 | 色哟哟国产精品色哟哟 | 91香蕉在线| 亚洲乱码视频 | 亚洲自拍中文字幕 | 亚洲一级精品 | 人成在线视频 | 五月婷婷六月综合 | 自拍偷拍亚洲天堂 | 嗯啊熟乳岳怀孕好深 | 久久久久久久久免费 | 在线aaa| 少妇无套内谢久久久久 | 狠狠干夜夜爱 | 日韩三级伦理 | 欧美高清hd| 久久特级毛片 | 欧美另类极品videosbest使用方法 | 色婷婷视频 | 在线天堂中文在线资源网 | 久久久久久精 | 91秦先生在线播放 | 久久aⅴ无码av高潮av喷吹 | 亚洲午夜精品久久久久久浪潮 | 久久精品高清 | 成年视频在线观看 | www.av在线视频 | 激情视频在线观看免费 | 小辣椒福利视频导航 | 校园春色综合 | 亚洲天堂日本 | 青青草伊人网 | 国产精品国产a级 | 永久免费在线视频 | 久久一区 | 黄色不卡| mm131丰满少妇人体欣赏图 | 久久一区二区三区四区 | 日本裸体女优 | 91福利视频网 | 青青草精品在线 | 成人吃奶视频 | 台湾swag在线播放 | 娇妻秘密进俱乐部穿环调教 | 亚洲精品水蜜桃 | 中文字幕观看在线 | 色哟哟在线免费观看 | 久久久精品影院 | 日日夜夜免费精品视频 | 手机在线免费看av | 五月综合视频 | 日韩中文字幕在线观看视频 | 成人免费在线视频 | 女性裸体视频 | 久久综合久久鬼 | 91禁蘑菇在线看 | 老湿机69福利区午夜x片 | 欧美福利视频 | 日韩特级黄色片 | 波多野结衣小视频 | 极品少妇一区二区三区 | 国产精选第一页 | 久久精品系列 | 九九精品视频在线观看 | 一区二区在线免费视频 | 男人肌肌桶女人肌肌 | 日韩一区二区视频在线 | 在线免费国产 | 精品香蕉一区二区三区 | 久久午夜影视 | 又大又粗又爽18禁免费看 | 精品人妻人人做人人爽夜夜爽 | 少妇真人直播免费视频 | 日韩最新| 大陆一级片| 国产探花一区 | 色就色欧美| 天天爽夜夜爽夜夜爽 | 成人教育av | 日韩视频在线一区 | 啊用力嗯轻一点 | 久久性色| 国产精品扒开腿做爽爽爽男男 | 日本免费福利视频 | 姐姐8免费完整高清电视剧在线看 | 国产欧美日韩综合 | 日韩久久免费 | a久久久久 | 欧美爽爽爽 | 久久视频在线免费观看 | 久久九九热 | 亚洲av成人无码一二三在线观看 | 丝袜美女被羞羞网站 | 中文字幕啪啪 | 国语播放老妇呻吟对白 | 啊啊啊啊啊好多水 | 九九热精品免费视频 | 国产强伦人妻毛片 | 免费的黄色小视频 | 韩国激情呻吟揉捏胸视频 | 亚洲欧美综合网 | 国产网站黄色 | 成人免费无遮挡无码黄漫视频 | 日本免费福利视频 | 亚洲欧洲日韩 | 日韩色综合 | 日本变态折磨凌虐bdsm在线 | 国产在线视频卡一卡二 | 日本三级视频在线 | 成人免费久久 | 香蕉视频在线网站 | 91色站| 姐姐8免费完整高清电视剧在线看 | 午夜精产品一区二区在线观看的 | 欧美精品在线一区 | 日韩在线一区二区三区四区 | 成年人网站在线 | 在线免费看av| 国产电影av | av网站在线免费观看 | 99热这里只有精品5 综合久久久久久久 | 久久久精品网 | 亚洲av永久中文无码精品综合 | 脱了内裤互相蹭很舒服 | 少妇人妻偷人精品无码视频新浪 | 又色又爽又黄18网站 | 蜜桃av乱码一区二区三区 | 婷婷九月 | 波多野结衣不卡 | 国产男同gay男男麻豆 | 国产毛片在线 | 色吧综合网 | 日韩毛片在线免费观看 | 日韩一区二区三区在线视频 | 亚洲精品一区二区三区区别 | 黄色wwww| 伦理片av | 亚洲区av | 久久久噜噜噜久久中文字幕色伊伊 | 亚洲精品一二三四 | 精品在线免费观看 | 国产一区二区精品丝袜 | 奇米影视888| 国产大尺度视频在线观看 | 国产视频久久 | 久久视频在线免费观看 | 西欧free性满足hd4k | 国产欧美a | 国产大尺度视频在线观看 | 伦理片av | 成人资源在线 | 综合激情在线 | 日本激情影院 | 性日本xxx| 午夜精品久久久久久久99热浪潮 | 激情五月色播五月 | 免费国产a| 免费黄色成人 | 三上悠亚被淫辱の教室下载 | 四虎黄色片 | 黄色应用在线观看 | 一级片免费在线播放 | 国产在线视频卡一卡二 | 极品白嫩少妇无套内谢 | 日韩在线免费av | 欧美日韩在线观看视频 | 被粗暴强迫侵犯在线观看 | 亚洲欧洲在线观看 | 欧美簧片在线 | 插入阴道视频 | 麻豆传媒观看 | 女同爱爱视频 | 国产特级毛片aaaaaa | 中文字幕视频 | 99啪啪 | 欧美极品少妇xxxxⅹ喷水 | 欧美另类高清 | 被粗暴强迫侵犯在线观看 | 亚洲尿pisssex撒尿 | 91精品久久久久久久99蜜桃 | 欧美三级电影在线 | 日韩欧美国产精品 | 欧美三级欧美一级 | 啊用力嗯轻一点h | 日本黄色大片免费 | 一区二区免费在线观看 | 3d肉腐团 | 啪啪视屏 | 国产视频一二区 | 女生喷水视频 | 污污在线| 国产精品久久九九 | 国产精品久久久久久无人区 | 日韩在线观看网站 | 99热在线播放| 午夜精产品一区二区在线观看的 | 偷偷在线观看免费播放电视剧大全 | 国产农村av | 伊人精品在线 | 99成人在线 | 久久亚洲国产成人精品性色 | 99久精品 | 国产精品电影一区二区 | 久久久精品福利 | 亚洲久久天堂 | 精品香蕉一区二区三区 | 一区二区在线免费视频 | 亚州av片 | 日本成人免费观看 | 国产精品天美传媒沈樵 | 爆操杨幂| 天天射影院 | 黄动漫在线观看 | 中文字字幕 | 色噜噜在线观看 | 午夜电影网站 | 国产老女人乱淫免费 | 97精品国产露脸对白 | 日韩在线视频不卡 | 亚洲一二三区在线观看 | 91网在线观看 | 性爱免费视频 | 在线观看麻豆视频 | 九色视频在线观看 | 一区二区三区精品视频 | 亚洲精品色 | 欧美色图在线观看 | 国产三级午夜理伦三级 | 免费高清毛片 | 丨国产丨调教丨91丨 | 亚洲一区二区高清 | 免费无码毛片一区二区app | 男同小说肉文 | 超碰免费人人 | 91在线观看免费 | 丁香花五月天 | 中文字幕在线观看一区 | 操女人逼逼视频 | 五月婷婷视频 | 六月色播 | 国产黄色在线观看 | 日本美女一级片 | 黑料视频在线观看 | 极品美女一区二区三区 | 久久久久国产精品人妻aⅴ院 | 久久一区 | 国产av无码专区亚洲av毛片搜 | 人人妻人人澡人人爽人人欧美一区 | 九色视频偷拍少妇的秘密 | 在线观看国产精品入口男同 | 美女免费网站 | 内地毛片 | 亚洲一区av在线 | 高潮毛片 | 不卡在线| 激情高潮呻吟抽搐喷水 | 亚洲一区二区三区视频 | 一区二区三区四区av | 成人91视频| 高跟肉丝丝袜呻吟啪啪网站av | 上司出差调教秘书hd | 激情网站在线观看 | 免费观看国产视频 | 久久99精品久久久久久琪琪 | 少妇被躁爽到高潮无码人狍大战 | 九九精品国产 | 亚洲图片欧美在线 | 泡妞wwwwxxxx | 精精久久 | 欧美三区四区 | 国产情侣小视频 | 国产三级午夜理伦三级 | 欧洲亚洲一区二区三区 | 欧美a在线观看 | 日韩精品999| 无遮挡美女| 日韩精品一区二区三区四区 | www日本在线观看 | 亚洲人成免费 | 乱色精品无码一区二区国产盗 | 大桥未久中文字幕 | 天天宗合 | 乱色精品无码一区二区国产盗 | 亚洲欧洲免费视频 | 亚州av综合色区无码一区 | 欧美色精品天天在线观看视频 | 波多野结衣在线播放 | 91福利在线观看 | 综合激情五月婷婷 | 波多野つ上司出差被中在线出 | 日本理论片中文字幕 | 女帝裸体被吸乳羞画 | 国产一区二区视频免费 | 日本国产视频 | 国产成人99久久亚洲综合精品 | 色内内电影网 | 美女xx视频 | 姐妹5电影高清全集在线观看免费 | av视屏| 欧美熟妇另类久久久久久不卡 | 青青草久久久 | 国产ts丝袜人妖系列视频 | 亚洲区av| 中文字幕第9页 | 91精品久久久久久久久中文字幕 | 亚洲综合一二三区 | 欧美一级片网站 | 黄色国产精品 | 日韩大片在线观看 | 免费黄色网址大全 | 亚洲天堂手机版 | 欧美日韩高清一区二区 | 久久久久久影视 | 亚洲欧美激情视频 | 欧美特级黄色录像 | 天天操天天射天天 | 美女福利视频 | 黄色片子视频 | 毛片女人 | 天天拍夜夜操 | 乌克兰毛片 | 日韩免费观看 | 久久精品7| 国产精品99久久久久久久久久久久 | 男生桶女生鸡鸡 | 草莓视频在线观看免费下载 | 91theporn国产在线观看 | 农民工hdxxxx性中国 | 小受受扒开屁股挨网站 | 67194国产 | 九九精品九九 | 在线高清观看免费观看 | 老司机精品福利导航 | 精品国产aⅴ一区二区三区东京热 | 国产99久久九九精品无码免费 | 羞羞漫画在线登录页面免费漫画入口页面cnmo | 17c在线观看视频 | 亚洲精品久久久久中文字幕二区 | 舔的好舒服 | 麻豆tv在线观看 | 日韩不卡在线观看 | 国产色av | 国产视频99 | 美日韩一级 | 亚洲成人精品一区二区 | 手机av免费看 | 国产高清在线观看 | 全黄一级男人和女人 | 亚洲精品日韩av | 成人在线观看一区二区三区 | 超碰最新网址 | 亚洲网站在线 | 受虐m奴xxx在线观看 | 五月天视频网 | 黄色网址在线免费观看 | 小宵虎南在线观看 | 欧美午夜精品久久久久久人妖 | 一区二区精品视频 | 久草综合在线视频 | 国产视频一区二区 | 看av网址| 北条麻妃一区二区三区免费 | 精品国产乱码久久久久久郑州公司 | 国产伊人久久 | 美女爆吸乳羞羞免费网站妖精 | 高清一区二区三区 | 成人精品视频一区二区三区尤物 | 影音先锋丝袜 | 九九天堂 | 韩国三级电影中文字幕 | 天天插一插 | 男女无遮挡免费视频 | 日韩成人午夜电影 | 少妇精品偷拍高潮白浆 | 天堂在线中文 | 国产精品人成在线观看免费 | 亚洲经典av | 婷婷丁香一区二区三区 | 吊侵犯の奶水授乳羞羞漫画 | 国产情侣一区 | 亚洲福利一区二区 | 亚洲成年网站 | 欧美私人影院 | 一边摸内裤一边吻胸 | 日韩福利网站 | 黄瓜av| 在线日韩电影 | 久久机热 | 精品欧美一区二区精品久久 | 日韩av中文在线 | 国产又爽又黄免费视频 | 经典av在线 | 公和我乱做好爽添厨房中文字幕 | 国产一级免费电影 | 打屁股无遮挡网站 | 男操女的逼 | 在线看国产精品 | www黄色网址 | 日韩在线观看第一页 | 国产性生活 | 爱爱网视频 | 一级特黄色| www.自拍偷拍 | 亚洲天堂2024 | 一级精品视频 | 伊人五月天| 欧美www视频| 免费无码毛片一区二区app | 丁香花高清在线 | 牛牛电影国产一区二区 | 人人爱超碰 | 中文字幕在线亚洲 | 亚洲色图欧美日韩 | 亚洲精品午夜 | 成人免费网站 | 麻豆入口 | 亚洲va在线观看 | 久久亚洲国产 | 不卡中文 | 欧美大片一区二区 | 粗大的内捧猛烈进出视频 | 97国产精品久久 | 超级碰碰视频 | yy7777777少妇光屁股 | 九色视频在线观看 | av在线毛片 | 久久精品7 | 福利视频一区二区三区 | 亚洲精品国产精品乱码不卡 | 岛国黄色片 | h片在线免费观看 | 国产男女猛烈无遮挡免费视频动漫 | 少妇精品偷拍高潮白浆 | 成人h在线观看 | 欧美性吧| 国产精品国产精品 | 日韩一区二区视频在线 | 亚洲一区二区高清 | 韩国美女视频在线观看18 | 国产免费一区二区三区在线观看 | 30一40一50老女人毛片 | 丰满大乳露双乳呻吟 | 青青草原免费观看完整版高清视频电视剧 | 成人性生交大片 | 国产精品7 | 欧美另类v| 日本久久久久久 | 老鸭窝成人 | 欧美一区二区高清 | 无人高清电视剧在线观看直播动漫 | 人人干人人干 | 亚洲一区在线视频观看 | 天堂网2018| 梦梦电影免费高清在线观看 | 久久久久久9 | 日韩一区二区精品 | 精品国产va久久久久久久 | 欧美性生活xxx | 青青草草 | 91福利视频在线观看 | 日本黄色美女视频 | 欧美资源 | 黄在线观看 | 娇妻被肉到高潮流白浆 | 神马久久久久久久久 | 男操女在线观看 | 国内精品免费视频 | 黑人一级片 | 永久免费,视频 | 日批国产| 亚洲一级精品 | 秋霞一区二区 | av在线手机观看 | 成人在线观看一区二区三区 | 久久综合激情网 | 日韩色图在线观看 | 中文亚洲欧美 | 天天天天躁天天爱天天碰2018 | 岛国av片| 久久av一区二区三区漫画 | 国模私拍xvideos私拍 | 我的丝袜美腿尤物麻麻 | 国产一区久久 | 欧美亚洲激情 | 粉嫩av网 | 公和我乱做好爽添厨房中文字幕 | 欧美9999| 精品麻豆 | 女女百合调教丨vk | 久久这里只有精品6 | www.av网站| 免费观看在线高清 | 久久精品噜噜噜成人 | 大地资源在线观看免费高清版粤语 | 久久久久久久av | 日本黄页网 | 美日韩免费视频 | 狠狠操免费视频 | 99久久国产视频 | 国产精品电影一区二区 | 色噜噜一区二区三区 | 美女大黄动图 | 香蕉网在线视频 | 人乳videos巨大吃奶 | 日韩三级久久 | 成人黄色在线 | 色呦呦在线视频 | 午夜黄色在线观看 | 东方影库av | av电影一区 | 激情一区 | 俄罗斯黄色大片 | 午夜久久久久久久久久影院 | 麻豆精品视频 | 亚洲av成人无码网天堂 | 欧美三级欧美一级 | 亚洲色图导航 | 男女网站免费 | 台湾三级台湾三级dvd影视 | 精品视频一区二区三区 | 欧美一级免费观看 | 按摩害羞主妇中文字幕 | 国产精品99久久久久久久久久久久 | 无码人妻精品一区二 | 在线观看日韩 | 浮力影院国产第一页 | 欧美福利视频网 | 久久88 | 韩国三级hd中文字幕的背景音乐 | 黄色av软件| 猛男办公室大战狂4p | 在线h网| 在线免费福利 | 97av视频在线 | 91亚洲精品国偷拍自产在线观看 | 被夫上司蹂躏的七天七夜在线观看 | 日韩中字在线 | 中国一级大黄大黄大色毛片 | 一本久久综合亚洲鲁鲁五月天 | 2022国产精品 | 美女抠逼喷水 | 大伊人网 | 欧美一区二区三区免费视频 | 亚洲午夜精品视频 | 久久久久成人精品无码 | 国产精品久久久精品 | 黄视频网站在线观看 | 九九热精品免费视频 | 美日韩一区二区 | 国产人妖一区二区 | 强行伸进她的小内裤疯狂揉摸视频 | 91麻豆成人 | 看片地址| 性感美女在线 | 国产精品8 | 国产又粗又猛又黄又爽无遮挡 | 少妇人妻偷人精品无码视频新浪 | 蜜桃视频网站18 | 久久9精品 | 亚洲九九| 玖玖在线视频 | 日韩成人免费在线视频 | 午夜精产品一区二区在线观看的 | 疯狂撞击丝袜人妻 | 深夜福利片| 影音先锋一区二区三区视频 | 玖草在线 | 亚洲男女啪啪 | 一级特黄aa大片欧美 | 欧美精品偷拍 | 精品久久久精品 | 亚洲一区中文字幕在线观看 | 亚洲色图国产精品 | 久久另类ts人妖一区二区 | 伊人狠狠| 欧美国产一级片 | 久久国内视频 | 欧美做受69 | 麻豆免费观看 | 亚洲成人精品一区二区 | 国产精品资源在线观看 | 91看片淫黄大片91桃色 | 国产综合在线观看 | 少妇肥臀大白屁股高清 | 中出在线观看 | 粗大的内捧猛烈进出视频 | 韩国黄色一级片 | 黄色网址视频 | 精品国产乱码久久久久久郑州公司 | 男女午夜激情 | 女生被男生插 | 精品看片| 国产午夜一级一片免费播放 | 善良的公与媳hd中文字 | 手机在线免费看毛片 | 欧美日韩在线一区二区三区 | 91成人在线 | 三级视频网址 | 床戏做爰摸亲胸视频 | 成人免费版欧美州 | 啊啊啊轻点插 | 免费看性生活视频 | 免费黄网在线观看 | 亚洲h片| 性生活一级视频 | 精品1区2区3区 | 在线天堂资源 | 痴汉电车在线观看 | 国产视频97 | 欧美看片 | 人人爱超碰| 波多野结衣在线观看 | 爱爱15p| 女人的超长巨茎人妖3d | 日本骚少妇 | 午夜精品三级久久久有码 | 日韩欧美中文 | 香蕉网久久 | 小舞被调教成奶奴魅魔视频 | 青青青免费在线视频 | 少妇精品偷拍高潮白浆 | 在线国产精品视频 | www.欧美色图| 丝袜天堂 | 男人的天堂a在线 | 操操操影院 | 中国特黄一级片 | 四虎在线免费视频 | 日本高清不卡视频 | 久久中文在线 | 一个人看的视频www 小宵虎南在线观看 | www香蕉 | 欧美大片黄 | 波多野结衣在线一区二区 | 国产+高潮+白浆+无码 | 草在线视频 | 我和几个阿的性事 | 思思精品视频 | 精品黑人一区二区三区在线观看 | 性感美女在线 | 国产ts系列| 欧美草逼网 | 69亚洲 | 免费看成人毛片 | 亚洲色视频 | 99re在线观看 | 秋霞啪啪片 | 免费看a级片| 亚洲综合p| 波多野一区 | 国产黑丝在线 | 9999国产精品 | 丰满的女人性猛交 | 三级黄色短视频 | 亚洲激情四射 | 欲色天天| 日本三级精品 | 久久精品视频一区 | 欧美精品www | 日韩毛片中文字幕 | 波多野结衣一区二区三区四区 | 伊人久久久久久久久 | 少妇邻居做爰5 | 长腿校花呻呤迎合娇躯白嫩小视频 | 天天操天天爽天天干 | 91九色视频在线观看 | 国产ts系列 | 婷婷色一区二区三区 | 黄色电影一级 | 出轨的女人高潮叫床视频网站 | 久久精品一区 | 久久av一区二区三区漫画 | 色欧美视频 | 天天干天天操天天爱 | 91搞搞 | 久久久久久国产视频 | 夜夜夜操操操 | 日韩大片在线观看 | 国产传媒av | 欧美日韩一区二区三区在线电影 | 人妻一区在线 | frxxeexxx麻豆hd | 精品视频999| 日韩色av| 国产h视频在线观看 | 高压监狱法版免费观看全部 | 91色交视频 | 手机av免费在线观看 | 日韩理论在线观看 | 超级碰碰视频 | 中文免费视频 | 91精品国产高清久久久久久久久 | 伊人影院综合 | 成人黄色在线观看 | 欧美激情午夜 | 女m被s玩胸虐乳哭着求饶 | 经典一区二区三区 | 国产91福利 | 国产精品a久久久久 | 一区二区不卡在线 | 久久99九九 | 国产精品丝袜 | 激情综合激情五月 | 亚洲三级黄色片 | 福利精品视频 | 无码人妻精品一区二区三应用大全 | 亚洲小视频在线观看 | 精品人妻人人做人人爽夜夜爽 | 麻豆三级| h文在线观看 | 91视频大全 | 欧美成人一区二区三区片免费 | 97精品久久 | 亚洲首页 | 又大又粗又爽18禁免费看 | 爱爱15p| 日韩在线一区二区三区四区 | 成人教育av | 国产无遮挡 | 老鸭窝成人| 狠狠视频 | 久久久久在线 | 国产精品无码在线播放 | 成年黄色网 | aa一级片| 我把护士日出水了视频90分钟 | 秋霞二区| 武则天一级淫片高清免费观看 | 成人aaa| 中文字幕人妻一区二区在线视频 | 日韩在线不卡 | www.激情五月| 人妻丰满熟妇av无码久久洗澡 | 在线视频导航 | 色男av| 日本三级免费看 | 亚洲视频一区二区 | 午夜性做爰电影 | 色一情一乱一伦一区二区三区 | 青青久草 | 黄瓜av | 欧美激情视频一区二区三区 | 成人综合激情网 | 国产一区二区不卡 | 少妇人妻丰满做爰xxx | 男人av在线| 国产精品成人免费看片 | 99热超碰| 日韩一区精品 | 午夜电影网站 | 羞羞漫画在线登录页面免费漫画入口页面cnmo | 屁屁浮力影院 | 亚洲一区中文字幕在线观看 | 3d动漫精品h区xxxxx区 | 中文字幕一区二区在线观看 | 国产三级伦理片 | 曰批女人视频在线观看 | 日本美女三级 | 中国黄色片子 | 中文字幕视频 | 色呦呦国产 | av免费高清 | 国产欧美日韩综合 | 青青草网站 | 外国av| 日韩精美视频 | 奇米影视77777 | 少妇被躁爽到高潮无码人狍大战 | 俄罗斯videodesxo极品 | 人人妻人人澡人人爽人人欧美一区 | 黄色动漫在线看 | 男人j进入女人j内部免费网站 | 成人资源在线观看 | av电影资源| 爱情岛论坛av | 高跟鞋和丝袜猛烈xxxxxx | 精品啪啪 | 欧美日韩第一区 | 玩偶姐姐在线观看免费 | 艳妇乳肉豪妇荡videos | 非洲黑人狂躁日本妞 | 欧美大片免费看 | 色婷婷欧美 | 情趣调教喷水h | 蜜桃成人在线观看 | 日韩av中文字幕在线 | av2017天堂网| 精品久久蜜桃 | 欧美色精品天天在线观看视频 | 日本精品久久 | 久久国产免费视频 | 日本人性爱视频 | 西西444www无码大胆 | 最新女另类z000z000 | 高跟鞋和丝袜猛烈xxxxxx | 萌白酱福利视频 | 免费黄色看片网站 | 国产精品熟妇一区二区三区四区 | 免费无遮挡无码永久在线观看视频 | 97在线观看视频 | 欧美久久久久 | 插吧插吧综合网 | 国内自拍偷拍 | 99性趣网 | 免费观看国产视频 | 日韩免费中文字幕 | 免费中文字幕在线观看 | 亚洲图片一区二区 | 日韩在线色 | free性video法国极品 | 少妇人妻精品一区二区三区 | 岳睡了我中文字幕日本 | 被陌生人强痴汉h | 免费观看黄色大片 | 黄色网战 | av导航网站 | 国产91在线播放 | 91亚洲精品国偷拍自产在线观看 | 日本一区二区三区在线免费观看 | 日韩av中文字幕在线播放 | 中国女人特级毛片 | 日日夜夜免费精品视频 | 国语久久| 欧美三级 欧美一级 | 伊人久久久久久久久 | 蘑菇视频hd在线 | 欧美二区在线 | 久久伊人精品视频 | 日本骚少妇 | 欧美视频一区二区三区四区 | 99热伊人 | 亚洲熟女乱色一区二区三区久久久 | 91片黄在线观看 | 香蕉啪啪| 日本韩国欧美中文字幕 | 日本变态折磨凌虐bdsm在线 | 一卡二卡三卡四卡五卡 | 久久新视频 | 丝袜天堂| 91五月天| 精品国产乱码久久久久 | 无人高清电视剧在线观看直播动漫 | 国产麻豆精品视频 | 亚洲人成免费 | 久免费一级suv好看的国产 | 超碰免费91| 天堂av一区 | 亚洲午夜免费视频 | 人碰人人 | 最新的黄色网址 | 亚洲一区中文字幕在线观看 | 欧美少妇xxxx | 99久久视频 | 成人自拍视频 | 日韩一级片在线播放 | 亚洲网在线| 欧美在线黄色 | 姐妹5电影高清全集在线观看免费 | 免费在线观看的av | 奇米影视77777 | 亚洲成在线 | 成人看片网 | 免费拗女稀缺资源观看 | 啪啪av| 在线免费观看日韩av | 男男全程肉无删减电影 | 伊人国产精品 | 玖玖在线免费视频 | 丝袜+亚洲+另类+欧美+变态 | 色一情一乱一伦一区二区三区 | 怡红院一区二区三区 | 美女爆吸乳羞羞免费网站妖精 | 天天天天躁天天爱天天碰2018 | 强行伸进她的小内裤疯狂揉摸视频 | 青青草原免费观看完整版高清视频电视剧 | 国产精品国产一区二区三区四区 | 国产国语性生话播放 | 夜晚福利视频 | 中文字幕第27页 | 欧美色精品天天在线观看视频 | 在线观看国产黄 | 91ts人妖另类精品系列 | 日韩三级av| 深夜福利你懂的 | 国产在线免费 | 色吧综合 | 俄罗斯黄色大片 | 亚洲男人天堂2019 | 欧洲三级电影 | 日批视频免费看 | 黄色永久网站 | 日本韩国在线观看 | 五十路熟女丰满大屁股 | 日韩中出 | 国产精品久久久久久久久久妞妞 | 开心激情播播 | 疯狂欧美大伦交乱 | 欧美视频久久久 | 日本成人毛片 | 扒开女人内裤猛进出白浆 | 国产精品一级 | 日韩欧美色图 | 欧美影院 | 亚洲综合一二三区 | 超碰激情 | 麻豆一二区 | 污的网站 | 国产1页 | 亚洲精品三区 | 欧美理论片在线观看 |- 特色檢測服務
- 醫療器械檢測
- 生物制品檢測
- 非臨床研究與生物樣本檢測
- 藥品檢測
- 病毒殺滅檢測
- 食品/保健食品檢測
- 其他檢測服務
-




 立即咨詢
立即咨詢 留言咨詢
留言咨詢



